Презентация на тему: Мониторинг неблагоприятных проявлений после иммунизации в соответствии с современными нормативными требованиями

Мониторинг неблагоприятных проявлений после иммунизации в соответствии с современными нормативными требованиями ГП «Государственный экспертный центр МЗ Украины»Васильева В.А.

Нормативная база осуществления мониторинга за НППИ в Украине Закон Украины «О лекарственных средствах» 1996 г. (с изменениями и дополнениями)Закон Украины «Про защиту населения от инфекционных болезней» 2000 г. (с изменениями и дополнениями) Закон Украины «Про обеспечение санитарного и эпидемиологического благополучия населения» 1994 г. (с изменениями и дополнениями) Приказы МЗ Украины:- 16.09.2011 №595 «Про порядок проведения профилактических прививок в Украине и контроль качества оборота медицинских иммунобиологических препаратов »;- 27.12.2006 №898 «Об утверждении порядка осуществления надзора за побочными реакциями ЛС, разрешенных к медицинскому применению в Украине» с изменениями, внесенными приказом МЗ от 29.12.2011 г. №1005

Кем осуществляется мониторинг за НППИ Осуществление мониторинга за НППИ возложено МЗ на Департамент медицинских иммунобиологических препаратов и иммунопрофилактики в структуре ГП «Государственный экспертный центр МЗ Украины»

Принцип осуществления мониторинга за НППИ Департамент медицинских иммунобиологических препаратов и иммунопрофилактики при ГП «Государственный экспертный центр МЗ Украины» получает информацию про случаи побочных реакций: - от территориальных СЭС (все случаи подозрения на осложнение или групповую реакцию без госпитализации); - руководителя ЛПУ(все случаи подозрения на осложнение или поствакцинальную реакцию с госпитализацией или летальным исходом) Приказ МЗ Украины №595 от 16.09.2011 г. от заявителей,специалистов с медицинским и/или фармацевтическим образованием всех учреждений здравоохранения, не зависимо от форм собственности;планируется от пациентов (интерактивная форма в стадии разработки для МИБП)Приказ МЗ Украины №898 от 16.09.2006 г. с изменениями внесенными приказом от 29.12.2011 г №1005

Для чего необходимо проводить мониторинг за НППИ при применении вакцин? Выявить редко встречающиеся реакции в том числе серьезныеСледить за увеличением частоты известных реакцийОпределить факторы риска развития ПР и разработать мероприятия, направленные на их предупреждениеВыявить серии, которые увеличивают частоту развития реакцийВыявить «сигналы» - регистрацию неблагоприятных проявлений с частотой, выше ожидаемой

Основные методы получения информации о безопасности вакцин в пострегистрационный период Оперативно- от специалистов с медицинским образованием всех учреждений здравоохранения, независимо от форм собственности (приказ МЗ №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);- от руководителей ЛПУ стационаров (приказ МЗ Украины №595 от 16.09.2011 г. )от территориальных СЭС (приказ МЗ Украины №595 от 16.09.2011 г. )Ретроспективно от территориальных СЭС 2 раза в год (приказ МЗ Украины №595 от 16.09.2011 г. )от заявителей (приказ МЗ №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005)

Изменения в репортировании про НППИ, согласно современным требованиям Заявитель информирует в виде очередных отчетов по безопасности (PSUR) о всех случаях, выявленных ПР (в том числе серьезных) в других странах, где использовался препарат (приказ МЗ Украины №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);Заполняется более детальная форма отчетности о зарегистрированных НППИ (реакции и осложнения) за полгода и год, где учитывается количество клинических проявлений ПР (Приказ МЗ Украины №595 от 16.09.2011 г.);Электронный адрес сайта, на котором размещается официальная информация о зарегистрированных реакциях/осложнениях за отчетный период при использовании вакцин, анатоксинов и аллергена туберкулезного dec.gov.ua (в рубрике «регистрация и контроль иммунобиологических препаратов»)

Специализированная экспертная оценка отчетов по безопасности МИБП В 2012 году получено 27 очередных отчетов по безопасности (PSUR) от 8 заявителей, из них на вакцины – 24 отчета;При перерегистрации проанализировано 29 обобщенных отчетов по безопасности (PSUR) МИБП, из них на вакцины – 9 отчетов;

Для чего необходимо проводить экспертную оценку отчетов по безопасности (PSUR) на МИБП? Обобщить все новые данные по безопасности вакцин, полученные из различных источников;Обобщить опыт применения вакцин в разных странах;В случае необходимости является основанием для внесения изменений и дополнений в инструкцию по применению препарата
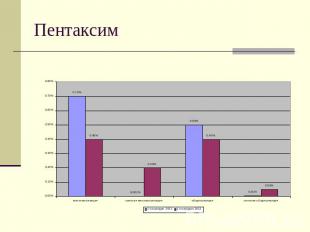
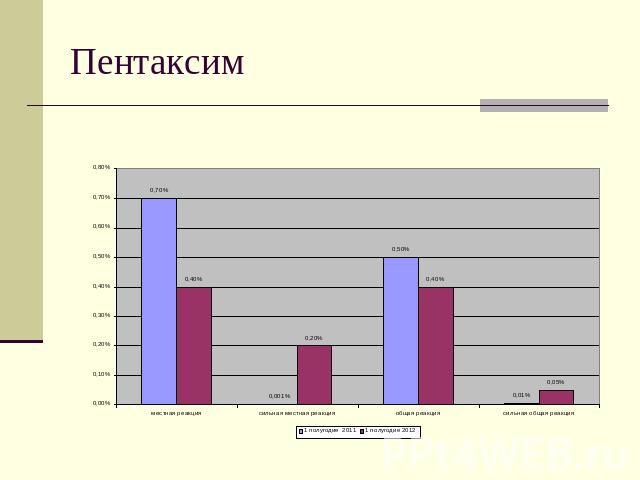
Пентаксим
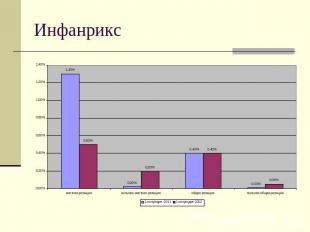
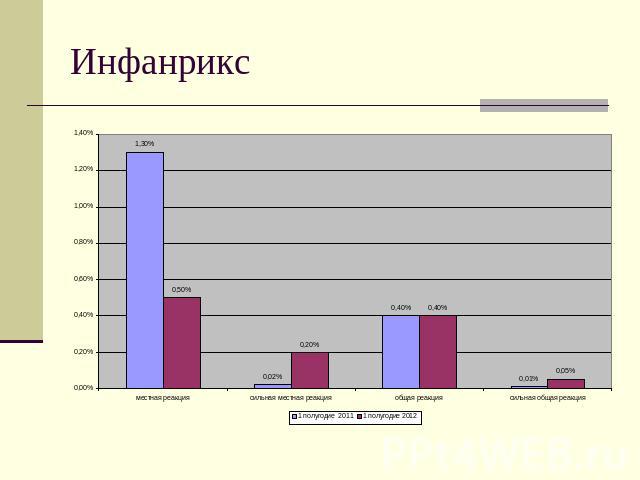
Инфанрикс

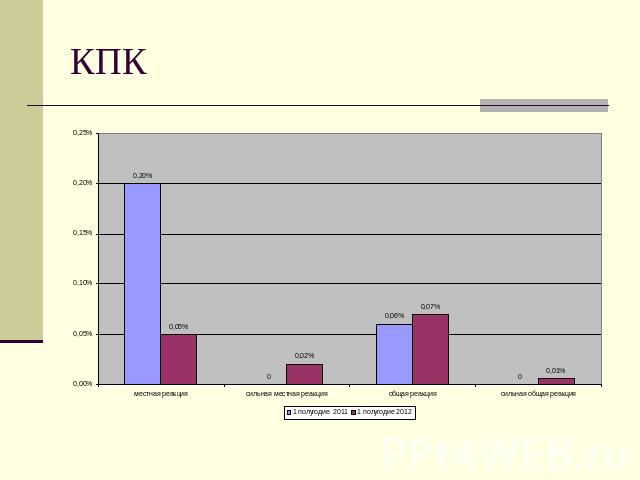
КПК
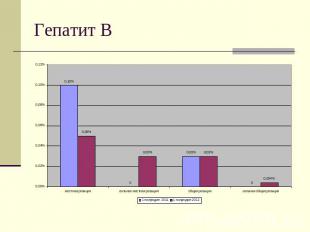
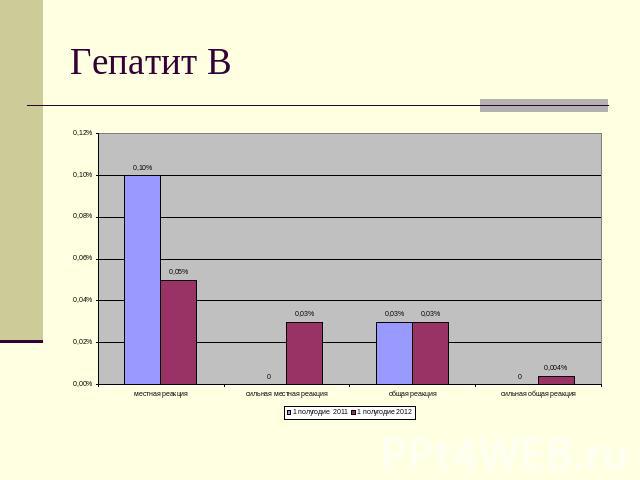
Гепатит В

Что необходимо для улучшения пострегистрационного надзора за НППИ? 1. Урегулирование вопроса по установлению запрета на использование серии или серий вакцин, а так же сроков снятия их с карантина, что требует немедленного внесения изменений в нормативную базу. 2. Стандартизация всех случаев ПР в соответствии с международной терминологией и их утверждение соответствующим приказом МЗ Украины;3. Налаживание системы репортирования про все случаи НППИ:- от всех заявителей/представителей (ф.137/о, утвержденная приказом МЗ Украины №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);- от специалистов с медицинским образованием всех учреждений здравоохранения, не зависимо от форм собственности (ф.137/о, утвержденная приказом МЗ Украины №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);- пациентов (интерактивная карта-сообщения);4. Требования к правильности заполнения граф оперативного сообщения про НППИ в случае госпитализации привитого в поствакцинальном периоде (приказ МЗ Украины №595 от 16.09.2011 г. );5. Усовершенствование электронной базы данных НППИ, случаи госпитализации, карт- сообщений на все серьезные ПР, несерьезные ожидаемые ПР по Украине, серьезные неожидаемые по странам, где используется вакцина;

Благодарю за внимание!