Презентация на тему: щелочные металлы 9 кл

ЩЕЛОЧНЫЕ МЕТАЛЛЫ

Цель урока: познакомиться с историей открытия и распространением щелочных металлов в природе и живых организмах; изучить физические и химические свойства щелочных металлов; узнать о применении этих металлов;

Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна металлическая кристаллическая решетка. У атомов металлов на внешнем уровне 1-3 электрона. У атомов металлов на внешнем уровне 1-3 электрона. Металлы являются восстановителями и окислителями. Для металлов характерна металлическая кристаллическая решетка. Металлы обладают электропроводностью и теплопроводностью. При взаимодействии с кислородом металлы принимают электроны. Все металлы активно взаимодействуют с кислотами. Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Мg, Be относятся к щелочноземельным металлам. Убери лишнее о металлах Слайд используется для актуализации знаний по теме металлы


История открытия Нахождение в природе Нахождение в живых объектах природы Физические свойства, особенности строения атомов Химические свойства Применение

В ЧЁМ УНИКАЛЬНОСТЬ ЩЕЛОЧНЫХ МЕТАЛЛОВ?

ИСТОРИКИ

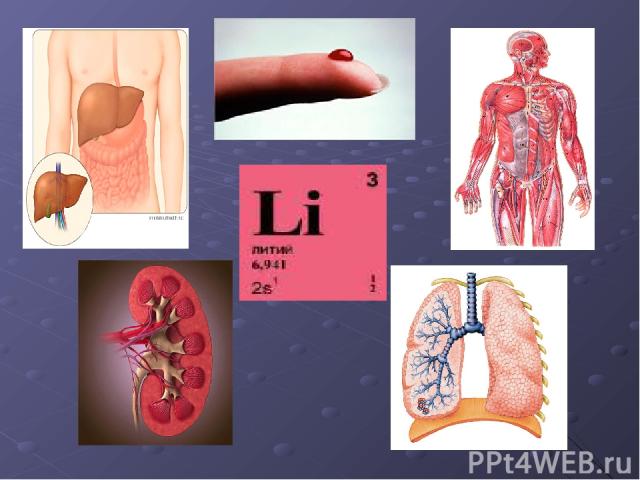
ЛИТИЙ (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минералапеталита LiAl[Si4O10]
![Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейши Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейши](https://fs3.ppt4web.ru/images/132003/171255/310/img10.jpg)
Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента № 3. В 1818 году металлический литий впервые получил английский учёный Гемфри Дэви. В 1855 году немецкому химику Бунзену и независимо от него английскому физику Матиссену удалось получить чистый литий электролизом расплава хлорида лития.

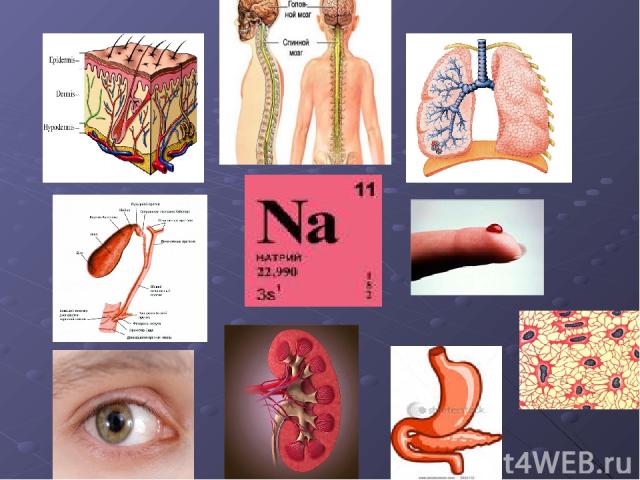
НАТРИЙ (Natrium)11Na Натрий – мягкий, серебристо – белый металл. В чистом виде получен при электролизе едкого натра английским химиком и физиком Гемфри Дэви в 1807 году и назван им « содием». В 1809 г. Л.В.Гильбер предложил название «натроний» (от арабского «натрун» – природная сода). В 1811 г. И.Я.Берцеиус изменил «натроний» на «натрий».

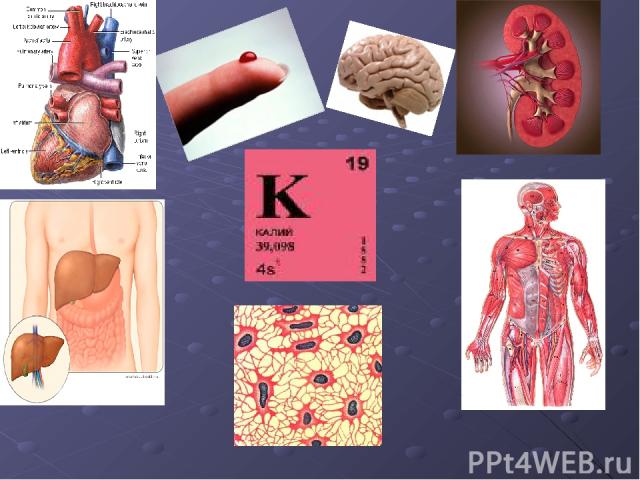
КАЛИЙ (Kalium) 19K Калий – серебристо-белый, очень мягкий и легкоплавкий металл. Получен при электролизе едкого кали в 1807г. английским химиком и физиком Гемфри Деви и назван им потассием. В 1809 г. Л.В.Гильберт предложил название « калий» (от арабского «аль-кали»)

РУБИДИЙ (Rubidium) 37Rb Рубидий – лёгкий и очень мягкий (как воск),серебристо-белый металл. Открыт в 1861 году по двум неизвестным ранее тёмно- красным линиям в спектре немецкими учёными Р. Бунзеном и Г. Кирхгофом. Цвет этих линий определил название: в переводе с латыни «рубидос»- -«тёмно-красный». «

ЦЕЗИЙ (Caesium) 55Cs Блестящая поверхность цезия имеет бледно-золотистый цвет. В 1860 году немецкие учёные Р. Бунзен и Г. Кирхгоф по синим линиям в спектре обнаружили в воде, взятой из минеральных источников Баварии, новый химический элемент. Название элемента: по латыни «цезиус»- «небесно-голубой».

Цезий, как известно, был первым элементом, открытым с помощью спектрального анализа, разработанного в 1859 году немецкими учёными –химиком Робертом Бунзеном и физиком Густавом Кирхгофом. Учёные, однако имели возможность познакомиться с этим элементом ещё до 1860 года. В 1846 году немецкий химик Платтер, анализируя минерал поллуцит, обнаружил, что сумма известных его компонентов, составляет лишь 93%, но не сумел точно установить, какой ещё элемент (или элементы) входит в минерал. В 1864 году, уже после открытия цезия, итальянец Пизани нашёл цезий в поллуците и установил, что именно соединения этого элемента не смог идентифицировать Платтер.

Франций (Franium) 87Fr Возможность существования и основные свойства элемента №87 были предсказаны Д.И.Менделеевым. В 1871 году в статье «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», он писал: «Затем в десятом ряду можно ждать ещё основных элементов, принадлежащим к I, II,III группам. Первый из них должен образовывать окисел- R2O, второй- RO, третий- R2O3 , первый из них будет сходен с цезием, второй- с барием, а все их окиси должны обладать, конечно, характером самых энергичных оснований». Исходя из местоположения экацезия в периодической системе, следовало ожидать, что сам металл будет жидким при комнатной температуре, так как цезий плавиться при 280 С.

Первое сообщение об открытии 87-элемента как продукта радиоактивного распада актиния-228 сделал в 1913 году английский химик Дж.Кренстон. Однако это осталось незамеченным. В 1914 году австрийские радиохимики- Мейер, Гесс и Панет- наблюдали явление разветвлённого распада изотопаАктиния-228 и установили, что продуктом альфа-распада 228Ac может быть элемент №87. Интересны теоретические работы одесского химика Д.Добросердова (1925) об атомном весе и свойствах 87- элемента, в случае открытия, он предлагал назвать его « руссием». В 1939г. французский химик Маргарита Пере заявила об открытии элемента №87 со свойствами щелочного металла, имеющего период полураспада 22 минуты, и назвала его «Актиний-К». В 1946 году она переименовала его в «Франций», в честь с своей родины.

ГЕОЛОГИ

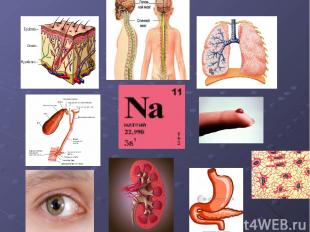
Нахождение в природе Натрий и калий широко распространены в природе в виде солей Соединения других щелочных металлов встречаются редко Кристаллы хлорида натрия – минерал галит Как очень активные металлы, они встречаются в природе только в виде соединений поташ Лепидолит- один из основных источников редких щелочных металлов, рубидия и цезия

БИОЛОГИ
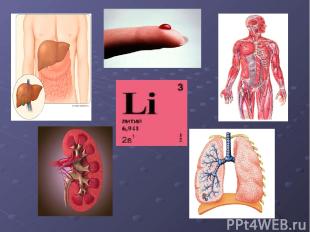


Среднее содержание в организме человека 608мг. Суточная потребность 1.5-6мг.

Суточная потребность 0,004-0,03мг

В организме человека не содержится.

ФИЗИКИ

ХИМИКИ

ТЕХНОЛОГИ - ПРАКТИКИ

LI

Na

K

Rb

Cs

Франций . Последний член семейства щелочных металлов франций настолько радиоактивен, что его нет в земной коре в более чем следовых количествах. Сведения о франции и его соединениях основаны на исследовании ничтожного его количества, искусственно полученного (на высокоэнергетическом ускорителе) при a-распаде актиния-227. Наиболее долгоживущий изотоп 22387Fr распадается за 21 мин на 22388Ra и b-частицы. Согласно приблизительной оценке, металлический радиус франция составляет 2,7 . Франций обладает большинством свойств, характерных для других щелочных металлов, и отличается высокой электронодонорной активностью. Он образует растворимые соли и гидроксид. Во всех соединениях франций проявляет степень окисления I.

Правильные ответы Б В Г В А

Согласны синий Не согласны красный

ИТОГОВАЯ ОЦЕНКА 10 – 12 баллов 5 8 – 10 баллов 4 6 – 8 баллов 3

ПАРАД МЕТАЛЛОВ, КАК ПАРАД ПЛАНЕТ, НЕТ ГЛАВНЫХ И ВТОРОСТЕПЕННЫХ НЕТ. МЕТАЛЛЫ РАЗНЫЕ ПО-СВОЕМУ ВАЖНЫ И В ЖИЗНИ ЧЕЛОВЕКА ВСЕ НУЖНЫ!

Домашнее задание Параграф 11 упр.2,3 Составить генетический ряд для любого щелочного металла








![ЛИТИЙ (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минералапеталита LiAl[Si4O10] ЛИТИЙ (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минералапеталита LiAl[Si4O10]](https://fs3.ppt4web.ru/images/132003/171255/640/img9.jpg)
![Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента № 3. В 1818 году металлический литий впервые получил английский учёный Гемфри Дэви. В 1855 году немецкому химику Бунзену и независимо от него англий… Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента № 3. В 1818 году металлический литий впервые получил английский учёный Гемфри Дэви. В 1855 году немецкому химику Бунзену и независимо от него англий…](https://fs3.ppt4web.ru/images/132003/171255/640/img10.jpg)