Презентация на тему: Химия. Щелочные металлы

Химия. Щелочные металлы Программа интересна и полезна для учащихся старших классов изучающих химию. В презентации помещено много дополнительного материала к уроку.

Меню Строение и свойства атомов. От металла к неметаллу. Добрый Литий. А где выгода? В чем же отличие? Самый известный ученый!

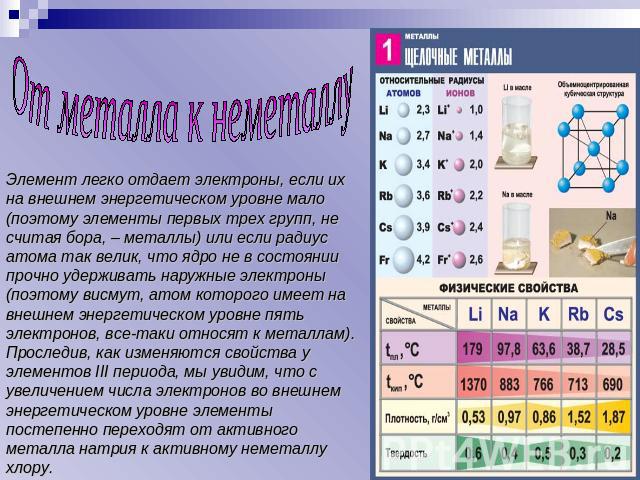
Строение и свойства атомов. Щелочные металлы - это элементы главной подгруппы 1 группы Периодической системы Д.И.Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.Франций – редкий радиоактивный элемент.На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями.Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Cs, что связанно с ростом радиусов их атомов.
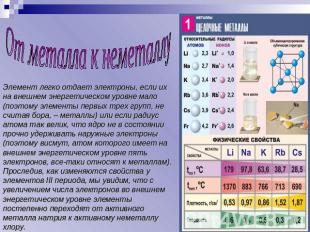
От металла к неметаллу Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому элементы первых трех групп, не считая бора, – металлы) или если радиус атома так велик, что ядро не в состоянии прочно удерживать наружные электроны (поэтому висмут, атом которого имеет на внешнем энергетическом уровне пять электронов, все-таки относят к металлам). Проследив, как изменяются свойства у элементов III периода, мы увидим, что с увеличением числа электронов во внешнем энергетическом уровне элементы постепенно переходят от активного металла натрия к активному неметаллу хлору.

Добрый Литий В большом семиэтажном доме, в подъезде щелочных металлов, навтором этаже жил Литий - самый легкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень легким и всплывал в керосине.Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле кислорода два своих электрона- каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен – отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития - четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие - при нагревании.И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?

А где выгода? Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны кислороду отдаешь? Не лучше ли делать так, как мы?»Отвечал Литий: «Я всегда рад помочь другим, не то что вы - жадничаете. Я рад, что в моем оксиде Кислород имеет свою обычную степень окисления -2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушел восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава M2O дают лишь тогда, когда их силой заставят, т.е. создадут соответствующие условия – нагревают пероксиды (Na2O2) с таким же металлом – «жадиной (Na)».

Открытие щелочных металлов Литий был открыт шведским химиком И. Арфведсоном в 1817г. и по предложению Й. Берцелиуса назван литием (от греч. литос – камень), так как в отличии от калия, который до тех пор находили только в золе растений, он был обнаружен в камне.Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807г. при электролизе едких щелочей. Й. Берцелиус предложил назвать элемент N 11 натрием (от араб. натрун – сода),а элемент N 19 по предложению Гильберта получил название калий (от араб. Алкали – щелочь).

В чем же отличие? По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче воды, а осмий тяжелее ее в 22,5 раза. Цезий или галлий можно легко расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет… Различна и химическая активность металлов – от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия. Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительные ионы. IV период тоже начинается активным металлом калием. В конце этого периода перед инертным газом криптоном также стоит активный неметалл бром. Следовательно, и в этом периоде должен происходить такой же переход. Почему же этот переход такой медленный? Дело в том, что у элементов IV периода от скандия до цинка «достраивается» не внешний энергетический уровень, а предыдущий. И лишь после цинка (начиная с галлия) число электронов на внешнем энергетическом уровне увеличивается, так что у германия здесь четыре электрона. Он – «пограничный» элемент, за которым следуют неметаллы. Поскольку у элементов от скандия до никеля на внешнем энергетическом уровне не больше двух электронов, то они металлы. Каждый большой период включает в себя подобный ряд, состоящий только из металлов.

Самый известный ученый! Периодическая таблица, которую Менделеев составлял с конца 1860-х годов, не сразу получила признание, но впоследствии сделала его самым известным русским ученым. В 1890 году он высказался в поддержку студентов, выступавших за социальную реформу, за что был уволен из университета. Но больше всего судьба была несправедлива к Менделееву, когда в 1906 году ему не хватило всего одного голоса для получения Нобелевской премии в области химии. Премия досталась Анри Муассану (Henri Moissan, 1852–1907), которому удалось выделить фтор — всего лишь один химический элемент, в то время как Менделеев создал классификацию их всех.