Презентация на тему: нуклеиновые кислоты

Обратимость химических реакций Химическое равновесие

Обратимые и необратимые реакции Необратимыми называют химические реакции, протекающие только в одном направлении. Обратимыми называют реакции, протекающие при одних и тех условиях и в прямом, и в обратном направлениях.

Обратимые и необратимые реакции При каких условиях данная реакция будет обратимой? Необратимой?

Химическое равновесие Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.

Смещение химического равновесия Принцип Ле Шателье (1884г.): если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
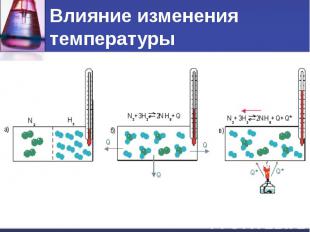
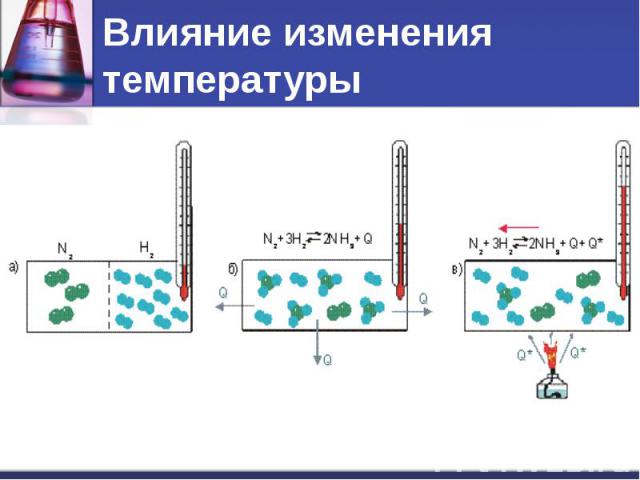
Влияние изменения температуры
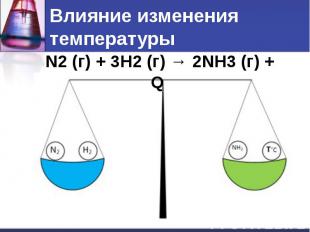
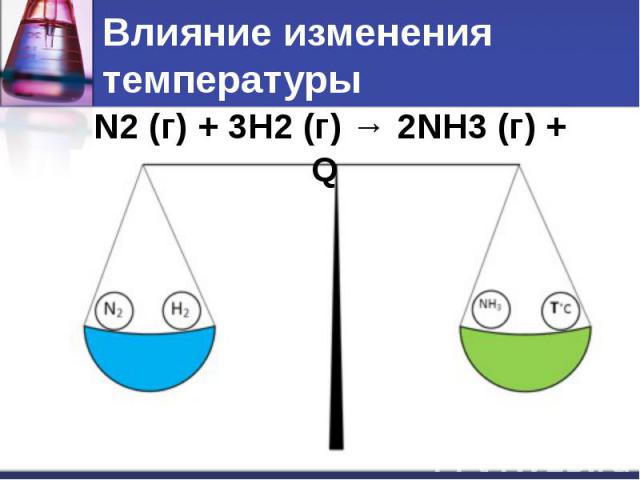
Влияние изменения температуры
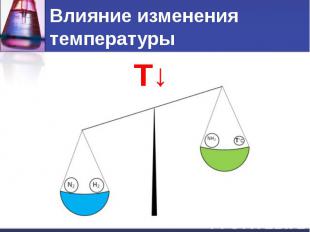
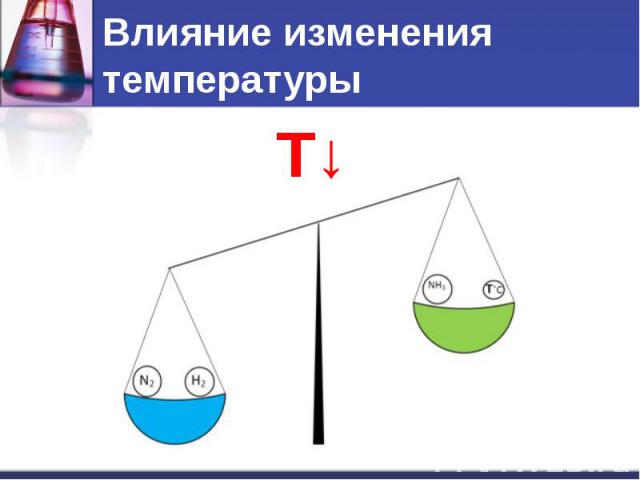
Влияние изменения температуры

Влияние изменения температуры При повышении температуры равновесие смещается в сторону эндотермической реакции. При понижении температуры – в сторону экзотермической реакции.
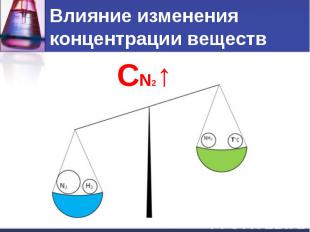
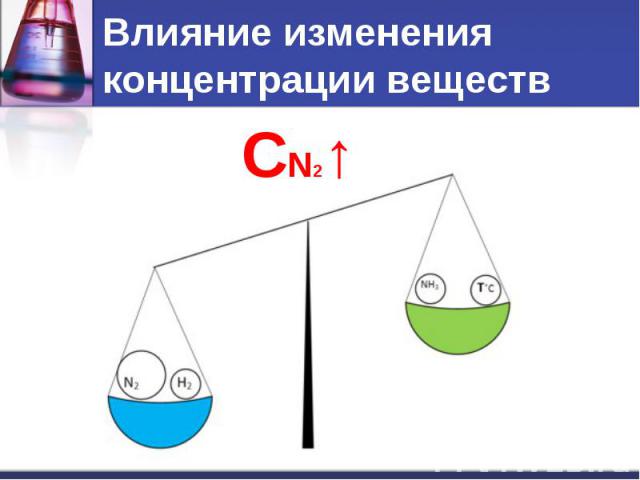
Влияние изменения концентрации веществ

Влияние изменения концентрации веществ При увеличении концентрации одного из веществ равновесие смещается в сторону его расходования. При уменьшении концентрации – в сторону его образования.
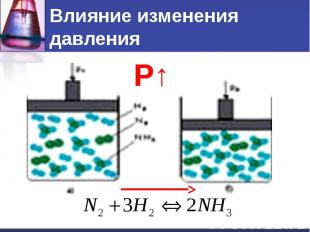
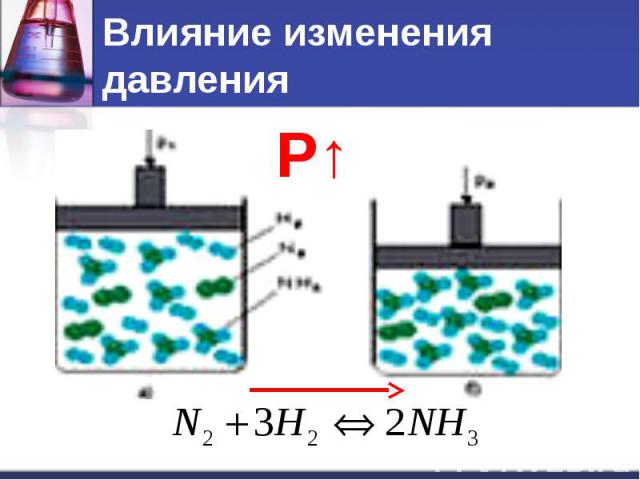
Влияние изменения давления

Влияние изменения давления При увеличении давления равновесие смещается в сторону той реакции, при которой объем образующихся газов меньше.

Катализатор: не влияет на смещение химического равновесия (он лишь ускоряет процесс его достижения)

Принцип Ле Шателье: