Презентация на тему: Щелочные металлы

Щелочные металлы
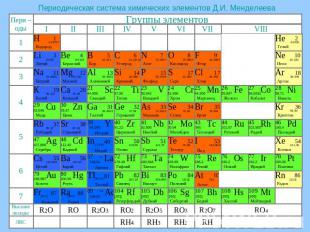
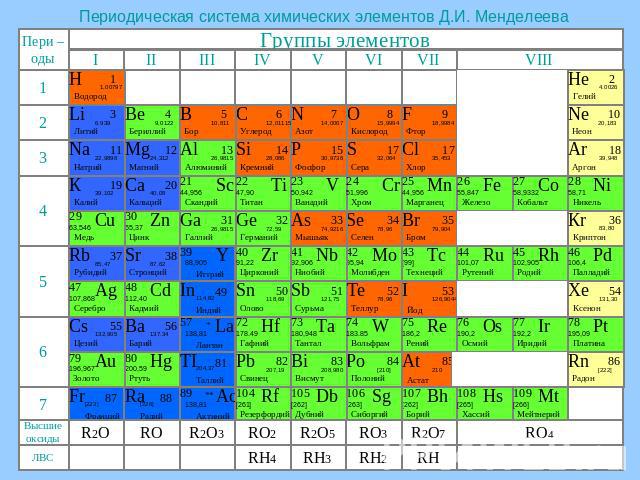
Периодическая система химических элементов Д.И. Менделеева

Строение и свойства атомов Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д.И. Менделеева: литий, натрий, калий, рубидий, цезий, франций. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
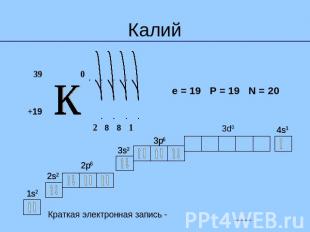
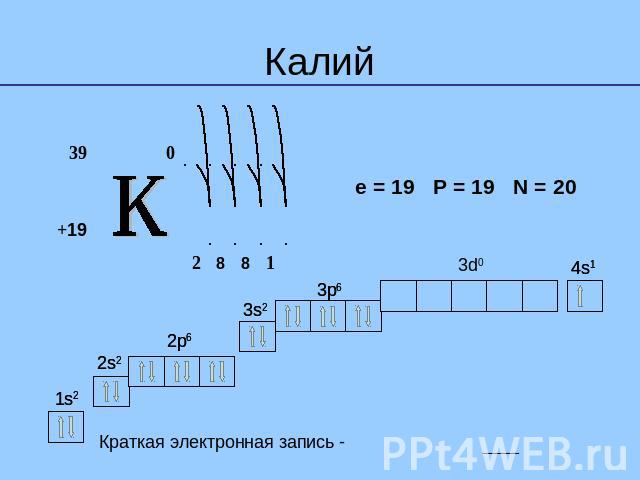
Калий

Щелочные металлы – простые вещества

Щелочные металлы

Цезий

Физические свойства Серебристо – белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они лёгкие и легкоплавкие, причём, как правило, плотность их возрастает от лития к цезию.

Химические свойства А) с простыми веществами 2Li + Н2 = 2LiН – гидрид лития; 2К + Сl2 = 2КСl – хлорид калия; 2Nа + S = Nа2S – сульфид натрия; 4 Li + О2 = 2Li2О – оксид лития. б) со сложными веществами 2Nа + 2НОН = 2NаОН + Н2

Реакция натрия с водой

Получение Литий был открыт шведским химиком И. Арфведсоном в 1817г и по предложению Й. Берцелиуса назван литием (камень), т.к. был обнаружен в камне.

Получение Натрий и калий впервые получены английским физиком и химиком Г.Дэви в 1807г при электролизе едких щелочей.

Получение Й. Берцелиус предложил назвать элемент №11 натрием (сода), а элемент №19 по предложению Гильберта получил название калий (щёлочь).