Презентация на тему: Сера и её соединения

Сера и её соединения Учитель химии МКОУ СОШ №3 с.Чикола РСО-АланияКадохова А.Г.

Девиз урока : « Жить – значит узнавать»
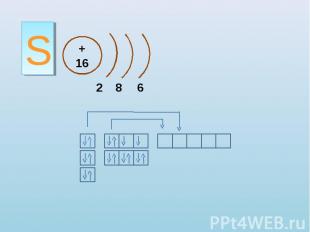
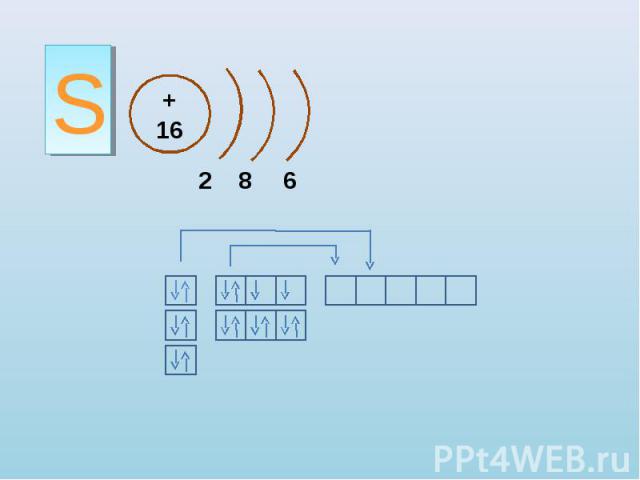
S + 16
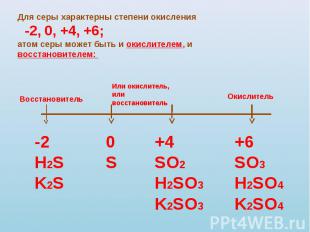
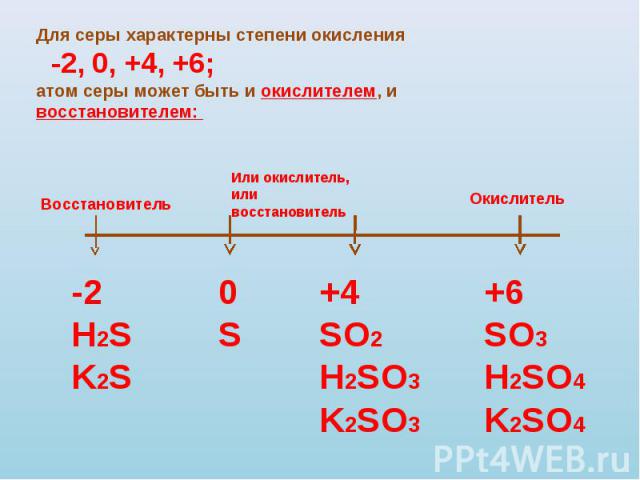
Для серы характерны степени окисления -2, 0, +4, +6;атом серы может быть и окислителем, и восстановителем: Восстановитель -2H2SK2S Или окислитель,или восстановитель 0S +4SO2H2SO3K2SO3 Окислитель +6SO3H2SO4K2SO4
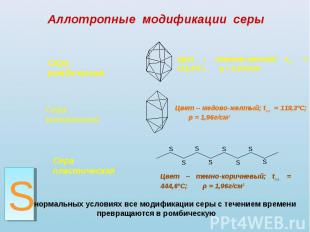
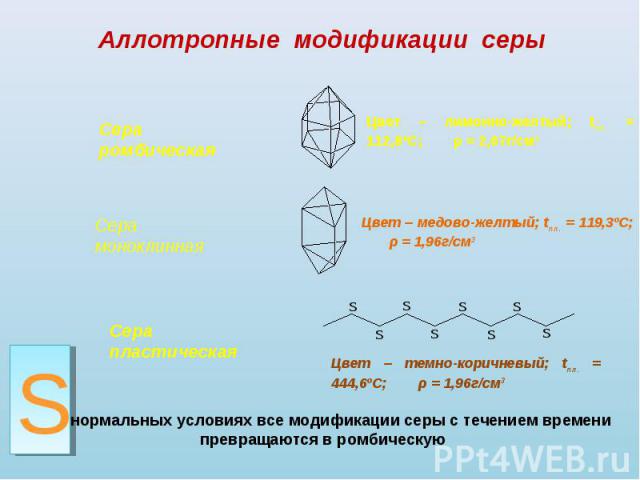
Аллотропные модификации серы Сера ромбическая Сера моноклинная Сера пластическая Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ = 2,07г/см3 Цвет – медово-желтый; tпл. = 119,3ºС; ρ = 1,96г/см3 Цвет – темно-коричневый; tпл. = 444,6ºС; ρ = 1,96г/см3При нормальных условиях все модификации серы с течением времени превращаются в ромбическую

У жёлтой серы есть корона,Но нет ни подданных, ни трона.Корону сера надевает,Когда устойчивой бывает.Нагрев ведёт к кристаллам длиннымБесцветной серы моноклинной.
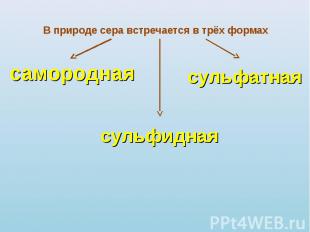
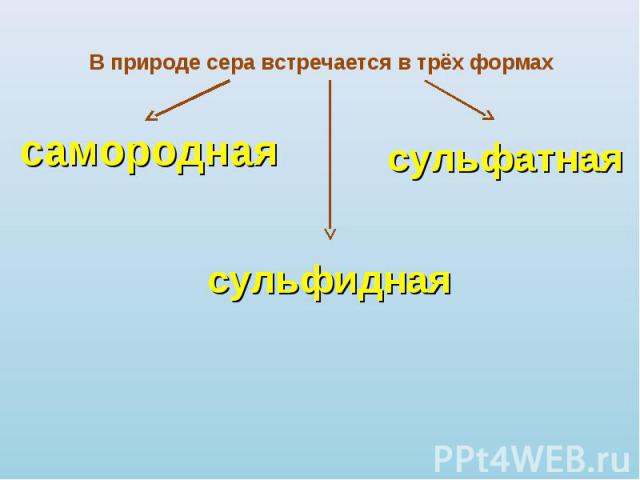
В природе сера встречается в трёх формах самородная сульфидная сульфатная

О каких соединениях серы упоминал А.С.Пушкин в стихотворении,написанном в 1832г.? Тогда услышал я (о диво) запах скверный,Как будто тухлое разбилося яйцоИль карантинный страж курил жаровней серной.Я, нос себе зажав, отворотил лицо… Ответ: о сероводороде H2S и диоксиде серы SO2, которыйс глубокой древности использовали для дезинфекции(окуривание горящей серой).

Химические свойства серы 1. Взаимодействие с металлами. восстановитель окислитель

Взаимодействие серы с натрием(видеоопыт) http://files.school-collection.edu.ru/dlrstore/3e6b77cf-8fff-882a-d3c3-c50221c6eba9/index.htm

2.Взаимодействие с водородом окислитель восстановитель
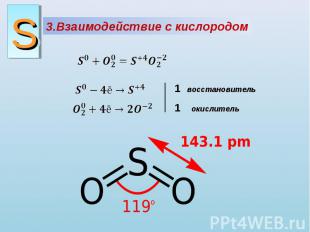
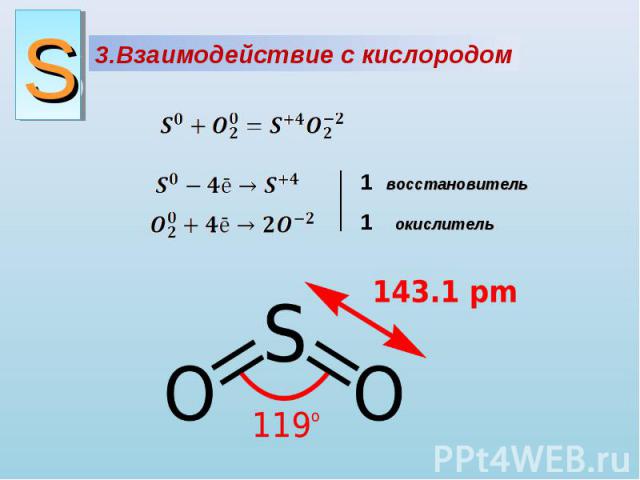
3.Взаимодействие с кислородом восстановитель окислитель

Диоксид серы – загрязнитель атмосферы

Уравнение реакции, в котором сера является окислителем:А. Zn + S → ZnS Б. 2SO2 + O2 → 2SO3 В. S + Cl2 → SCl2 Г. SO3 + H2O → H2SO4 Свойство, не характерное для серы: А. Растворима в воде Б. Не проводит электрический ток В. твердое вещество желтого цвета Г. Горит Сумма всех коэффициентов в уравнении реакции: MgS + O2 → MgO + SO2А. 4 Б. 6 В. 9 Г. 12

ДОМАШНЕЕ ЗАДАНИЕ:§22, упр. 1, 2.