Презентация на тему: сера и её соединения

СЕРА И ЕЁ СОЕДИНЕНИЯ Учитель химии МБОУ СОШ №7 Миронова Е.А. Дубна, 2015
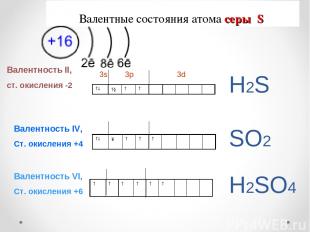
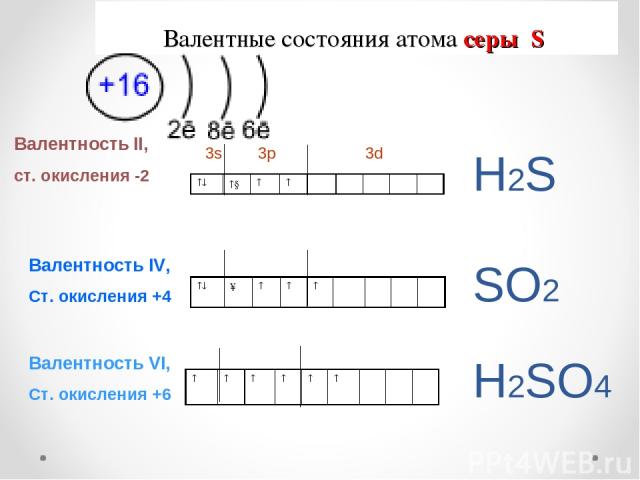
Валентные состояния атома серы S Валентность II, ст. окисления -2 3s 3p 3d Валентность IV, Ст. окисления +4 Валентность VI, Ст. окисления +6 Н2S SО2 Н2SО4 ↓ ↑
Физические свойства серы Твёрдое кристаллическое вещество желтого цвета, без запаха Плохо проводит теплоту и не проводит электрический ток Сера в воде практически не растворяется Температура плавления 1200С

Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде.
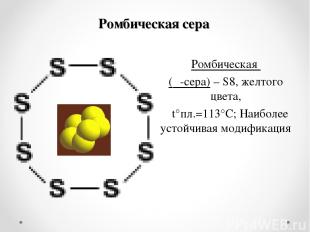
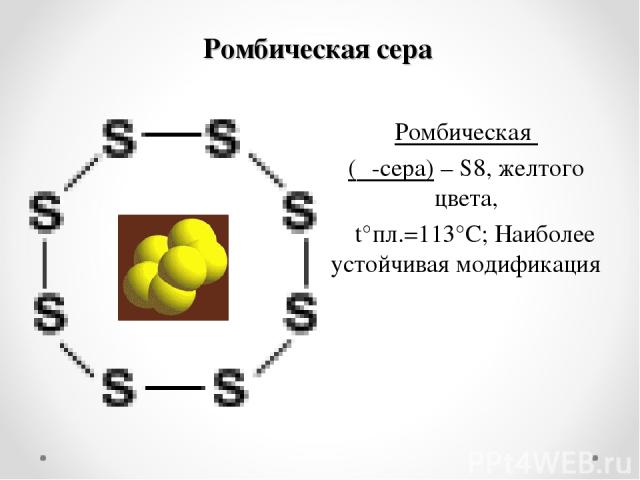
Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
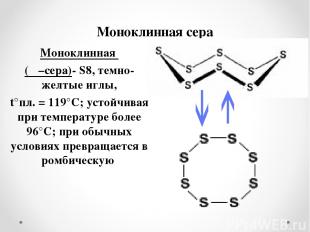
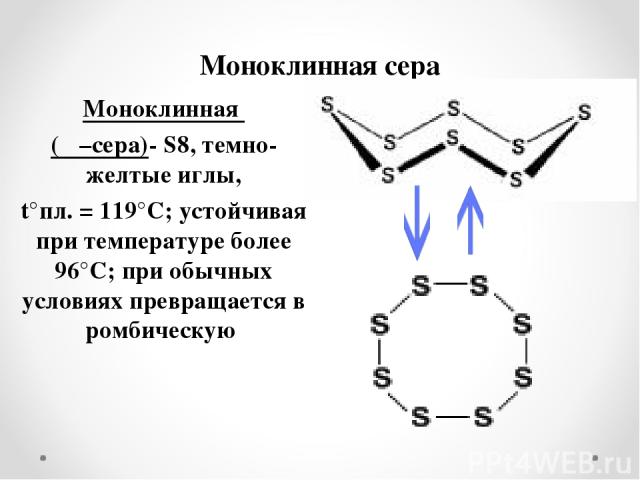
Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую

Пластическая сера Пластическая сера коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е превращается в ромбическую серу

Химические свойства серы (восстановительные) Сера проявляет в реакциях с сильными окислителями: S - 2ē S+2; S - 4ē S+4; S - 6ē S+6 1) С кислородом S + O2 t S+4O2 2S + 3O2 t ;Рt 2S+6O3 2) С галогенами (кроме йода) S + Cl2 S+2Cl2 3) С кислотами - окислителями: S + 2H2SO4(конц) 3S+4O2 + 2H2O S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O

Химические свойства серы (окислительные) S0 + 2ē S-2 4) Сера реагирует со щелочными металлами без нагревания,c остальными металлами (кроме Au, Pt) – при повышенной t : 2Al + 3S –t Al2S3 5) С некоторыми неметаллами сера образует бинарные соединения: H2 + S H2S 2P + 3S P2S3 C + 2S CS2

Сероводород Газ бесцветный запах тухлых яиц ядовит хорошо растворим в воде (сероводородная кислота) FeS + 2HCl= FeCl 2 + H 2S

1) Горение сероводорода. Полное сгорание (при избытке O2) 2H2S-2 + 3O2 → 2S+4O2 + 2H2O Неполное сгорание (недостаток O2) 2H2S-2 + O2 → 2S0 + 2H2O

. H2S-2 + Br2 → S0 + 2HBr H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl 2) Восстановительные свойства (с галогенами, солями, кислородом, кислотами).

. Взаимодействует с основаниями: H2S + 2NaOH изб. → Na2S + 2H2O H2S изб. + NaOH → NaHS + H2O сульфид натрия гидросульфид натрия 3) Кислотные свойства.

. Н2S + Pb(NO3)2 → PbS↓ + 2HNO3 Pb2+ + S2- → PbS↓ черный черный 4) Качественная реакция на сероводородную кислоту и сульфиды. H2S + Cu(NO3)2 → CuS↓ + 2HNO3 Сu2+ + S2- → CuS↓

Диоксид серы 4 Fe S2 + 11 O2 = 2 Fe2 O3 + 8 S O2 газ бесцветный запах резкий, удушающий tкип = -10С
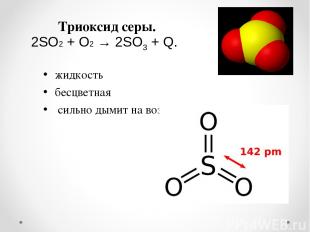
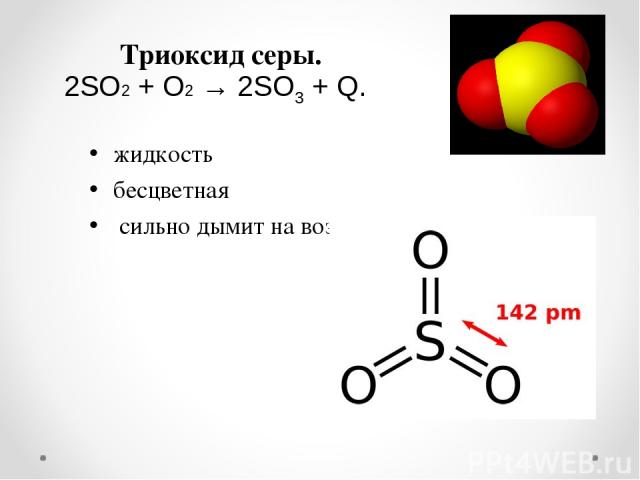
Триоксид серы. жидкость бесцветная сильно дымит на воздухе 2SO2 + O2 → 2SO3 + Q.