Презентация на тему: Азот. Аммиак

Учитель химии МБОУ СОШ №7 Миронова Е.А. Дубна, 2016
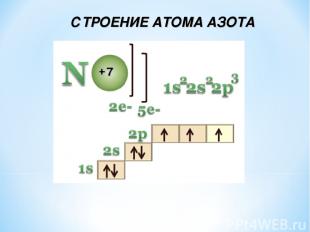
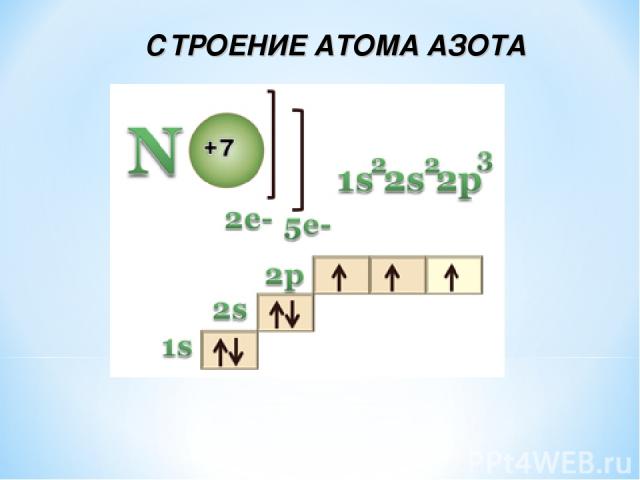
СТРОЕНИЕ АТОМА АЗОТА

Распростаненность азота Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму). Содержится азота в земной коре в верхней части мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов. Содержится азота в гидросфере в виде соединений.
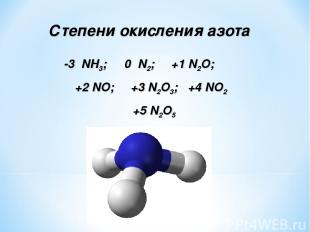
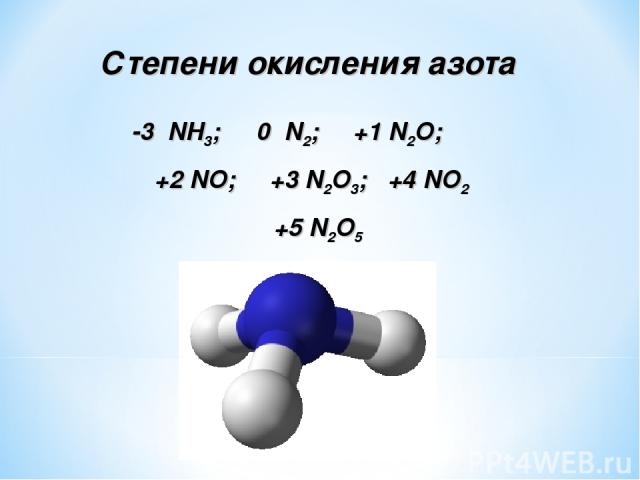
Степени окисления азота -3 NH3; 0 N2; +1 N2O; +2 NO; +3 N2O3; +4 NO2 +5 N2O5

Азот – простое вещество. Азот – это газ, без цвета, запаха, вкуса. Строение молекулы. Молекула азота образована ковалентной неполярной связью

Химические свойства азота В химическом отношении азот довольно инертный газ из-за прочной ковалентной связи. 1. Взаимодействие с металлами. Свободный азот реагирует в обычных условиях только с литием, образуя нитрид: 6Li + N2 = 2Li3N 2. Взаимодействие с водородом. При взаимодействии азота с водородом при нагревании, повышенном давлении и присутствии катализатора образуется аммиак: N2 + 3H2 = 2NH3 3. Взаимодействие с кислородом (при высокой температуре) N2 + O2 = 2NO

Получение азота В лабораториях его можно получать 1. По реакции разложения нитрита аммония: NH4NO2 → N2↑ + 2H2O 2. Нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4 (NH4)2Cr2O7 →(t) Cr2O3 + N2↑ + 4H2O 3. Пропускание аммиака над оксидом меди (II) при температуре ~700°С: 2NH3 + 3CuO → N2↑ + 3H2O + 3Cu Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха.

Аммиак Физические свойства Аммиа к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
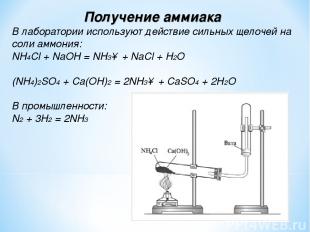
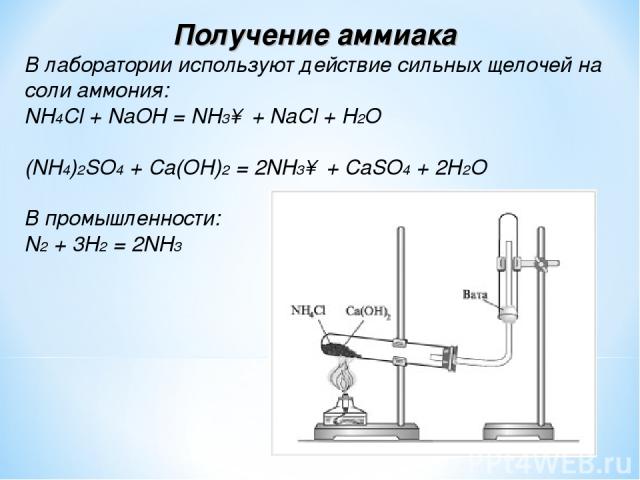
Получение аммиака В лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O (NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O В промышленности: N2 + 3H2 = 2NH3
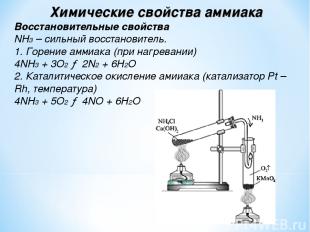
Химические свойства аммиака Восстановительные свойства NH3 – сильный восстановитель. 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H2О 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O

Образование связи по донорно-акцепторному механизму Катион аммония получается в результате того, что атом азота имеет свободную (неподеленную) электронную пару, за счет которой и формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул кислот или воды: Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным.

Взаимодействие с водой и кислотами NH3 + Н2О NН4 ОН NH3 + HCl = NH4Cl 2NH3 + H2SO4 = (NH4)2SO4

Соли аммония 1. Вступают в обменную реакцию с кислотами и солями: (NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3 (NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑ 2. Взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония: NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O 3. Разлагаются при нагревании NH4Cl → NH3↑ + HCl

Литература и интернет-источники 1. Строение атома азота http://festival.1september.ru/articles/534347/ 2. Прибор для получения аммиака http://primwiki.ru/index.php 3. Горение аммиака в кислороде https://him.1september.ru/2003/38/7.htm