Презентация на тему: «Реакции ионного обмена»

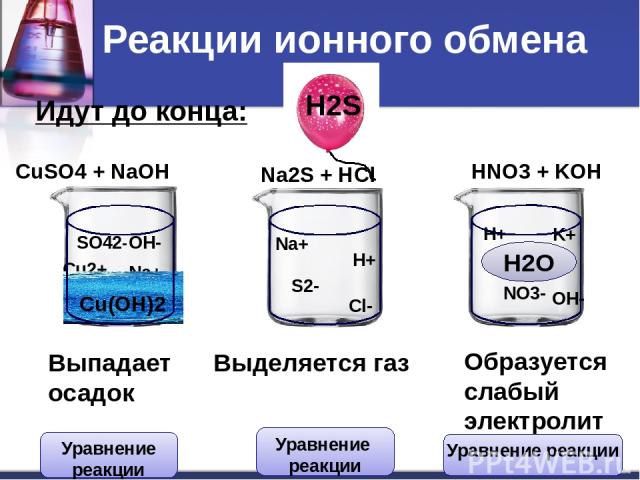
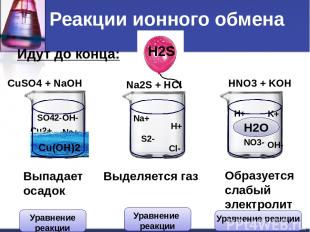
Идут до конца: CuSO4 + NaOH Na2S + HCl HNO3 + KOH Cu2+ SO42- Na+ OH- Na+ S2- H+ Cl- H+ NO3- K+ OH- Сu(OH)2 H2S H2O Выпадает осадок Выделяется газ Образуется слабый электролит Реакции ионного обмена Уравнение реакции Уравнение реакции Уравнение реакции

научить школьников составлять ионные уравнения реакций; рассмотреть условия протекания реакций ионного обмена до конца; формировать системный подход и способность предсказывать результат реакций на основе полученных знаний; раскрыть значение реакций ионного обмена. Презентация может быть использована для дистанционного обучения
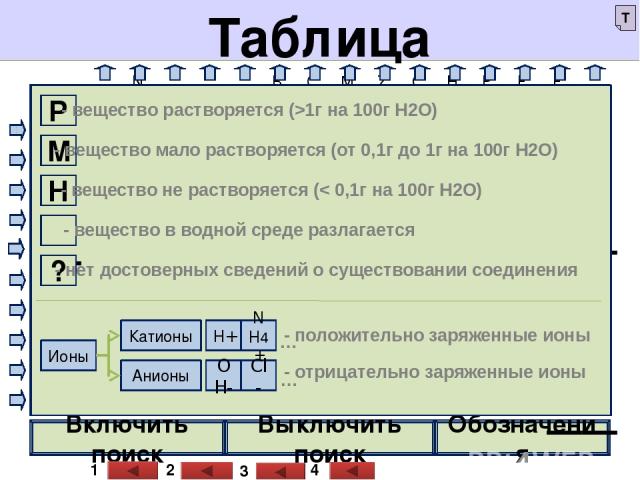
Слайд 6. Определение условий прохождения реакций «до конца» (курсор наводим на стаканы –клик). Выпадение осадка –записываем уравнение реакции -клик. Слайд 7. При определении растворимости веществ используем таблицу . После записи реакции в ионном виде возвращаемся на слайд 6. Выделение газа, образование слабого электролита (действия аналогичны). В слайдах 15-20 используются триггеры. На слайде 19 проверка ответов – клик на цифры . Правильный ответ , неправильный ответ .

Алгоритм составления уравнений Молекулярное уравнение CuSO4+2NaOH = Cu(OH)2 + Na2SO4 Полное ионное уравнение Сокращенное ионное уравнение Cu 2+ + SO4 2- + 2 Na + + 2 OH - = Cu(OH)2 + 2 Na + + SO4 2- Cu 2+ + 2OH - = Cu(OH)2 1.Записать уравнение реакции в молекулярном виде 2.По таблице растворимости определить растворимость каждого вещества 3.Составить полное ионное уравнение (записать диссоциацию растворимых исходных веществ и продуктов реакции) 4.Найти одинаковые ионы в левой и правой частях, сократить их и записать сокращенное ионное уравнение Т1
Составление уравнений Молекулярное уравнение HNO3+KOH = KNO3 + H2O Полное ионное уравнение Сокращенное ионное уравнение H + + NO3 - + K + + OH - = H2O + K + + NO3 - H + + OH - = H2O Т3

Составление уравнений Молекулярное уравнение Na2SO4+2KNO3 2NaNO3 + K2SO4 Полное ионное уравнение 2Na + + SO4 2- + 2 K + + 2 NO3 - + 2 K + + SO4 2- 2 NO3 - Na + + 2 Обратимые реакции – реакции, идущие во взаимно противоположных направлениях Т4
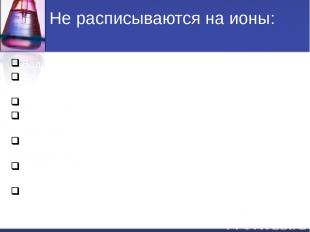
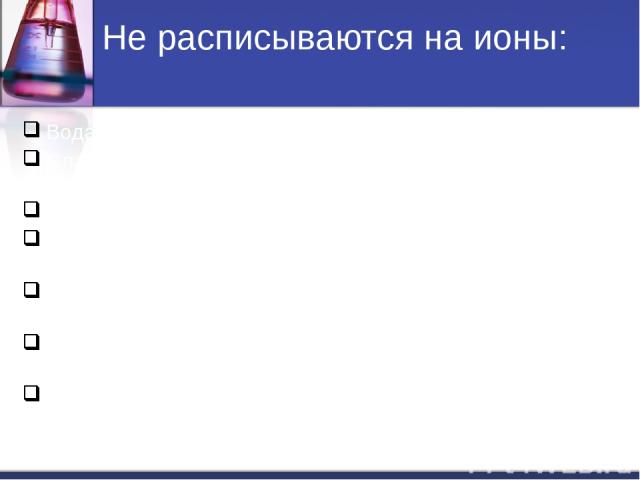
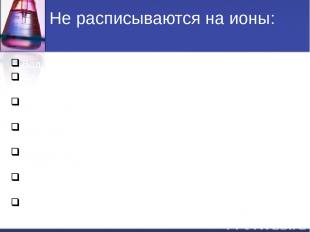
Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.). Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3, FeS и др.). Амфотерные гидрооксиды (↓): Al(OH)3, Zn(OH)2, Cr(OH)3 и др. Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.). Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и т.д).


Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые и нерастворимые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.). Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3, FeS и др.). Амфотерные гидрооксиды (↓): (Al(OH)3, Zn(OH)2, Cr(OH)3 и др.). Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.). Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и др.).

Обратимые реакции Na2SO4 + KNO3 Na+ SO42- K+ NO3- 1.Нет осадка 2.Не выделяется газ 3.Не образуется слабый электролит
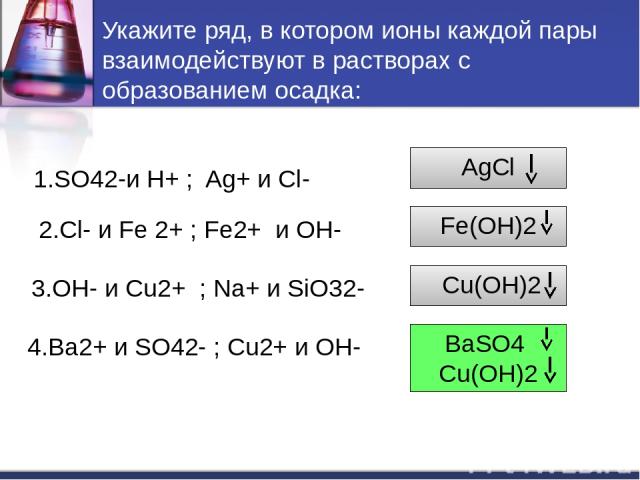
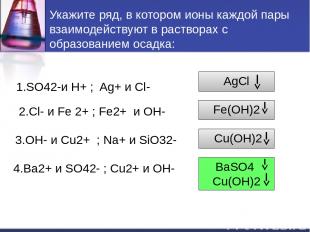
Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием осадка: 1.SO42-и H+ ; Ag+ и Cl- 2.Cl- и Fe 2+ ; Fe2+ и OH- 3.OH- и Cu2+ ; Na+ и SiO32- 4.Ba2+ и SO42- ; Cu2+ и OH- AgCl Fe(OH)2 Cu(OH)2 BaSO4 Cu(OH)2

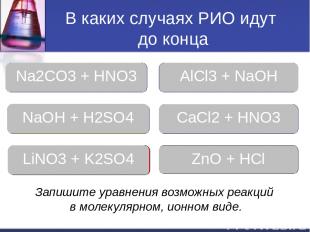
В каких случаях РИО идут до конца Молодец Молодец Молодец Ошибка Ошибка Молодец Na2CO3 + HNO3 AlCl3 + NaOH NaOH + H2SO4 CaCl2 + HNO3 LiNO3 + K2SO4 ZnO + HCl Запишите уравнения возможных реакций в молекулярном, ионном виде.

Сокращенное ионное уравнение реакции соответствует взаимодействию: 2H+ + CO32- = CO2 + H2O 1.2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O 2.2HCl + MgCO3 = MgCl2 + CO2 + H2O 3.H2SO4 + CaCO3 = CaSO4 + CO2 + H2O 4.2HCL + Na2CO3 = 2NaCL + CO2 + H2O Правильно Ошибка
Сокращенное ионное уравнение реакции соответствует взаимодействию: Al2O3 + 6H+ = 2Al3+ + 6H2O 1.Al2O3 + 3CO2 = Al2(CO3)3 2.Al(NO3)3 + 3KOH = 3KNO3 + Al(OH)3 3.Al2O3 + 3H2SO4 = Al2(SO4)3 + 6H2O 4.AlCL3 + H2O = AlOHCl2+ + HCl Правильно Ошибка
Назовите числа правильных ответов 1.Выберите ряд, в котором каждое вещество не записывается в виде ионов при составлении ионных уравнений. Вопрос 1. Вопрос 2. Вопрос 3. Вопрос 4. H2S, Na2S, CuSO4 CO2, H2SiO3, H2SO3 KCl, Ca(HCO3)2, HI H2CO3, K2CO3, Cu(OH)2 1 2 3 4 Сокращенное ионное уравнение H+ + OH- = H2O соответствует реакции: H2SO4+Zn(OH)2 HCl + Al(OH)3 HNO3 + NaOH H2CO3 + KOH 1 2 3 4 Выберите пары веществ, которые в водном растворе взаимодействуют с образованием газа. Na2SO3 и HNO3 KHCO3 и HCl NaHS и NaOH NaHS и H2SO4 1 2 3 4 Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции Fe(OH)3 + H2SO4= равны соответственно: 28 и 3 22 и 16 28 и 18 14 и 10 1 2 3 4 Вопрос

Применение Ионитами называют вещества или материалы, способные к обмену ионов при соприкосновении с растворами электролитов Цеолит Ионообменные смолы

Применение ионитов Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит. Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо. Очистка сточных вод промышленных предприятий. Очистка воды
Применение ионитов В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина, глюкозы, сгущенного молока, какао, кофе со сгущенным молоком.

Применение ионитов Для извлечения металлов С помощью ионитов извлекаются редкие и рассеянные элементы из полиметаллических руд. В сельском хозяйстве иониты используются для доставки растениям необходимых им элементов. Mo W

1.Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. 2.Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит. 3.Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо. 4.Очистка сточных вод промышленных предприятий.

В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина, глюкозы, сгущенного молока, какао, кофе со сгущенным молоком

Литература Неорганическая химия(в схемах, рисунках, таблицах, формулах, химических реакциях), А.П. Гаршин, «Лань» Санкт-Петербург,2000г Книга для чтения по неорганической химии. В. А. Крицман, Москва «Просвещение»1994г. Химия 8 класс. О.С. Габриелян, Москва «ДРОФА» 2014г.

В медицине: 1.Для увеличения сроков хранения крови. 2.Для производства, выделения и очистки антибиотиков. 3.Использование ионитов, селективно извлекающих токсические вещества из крови человека