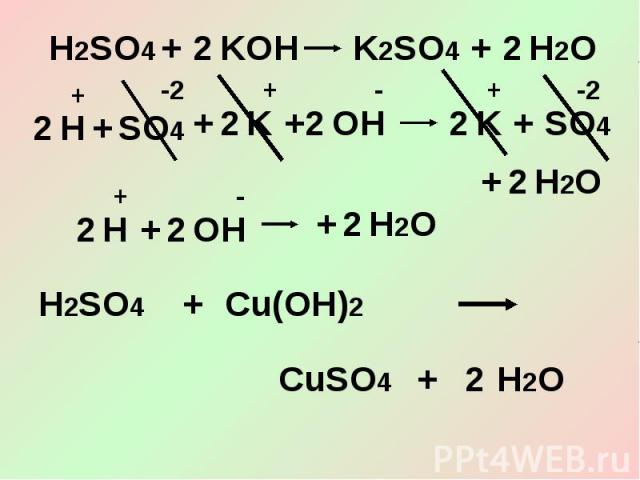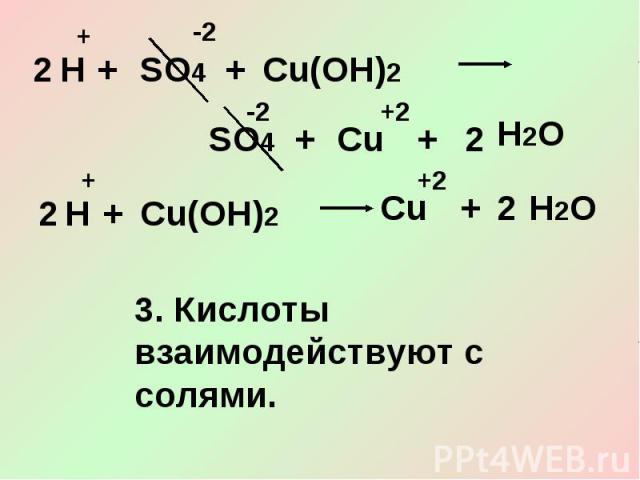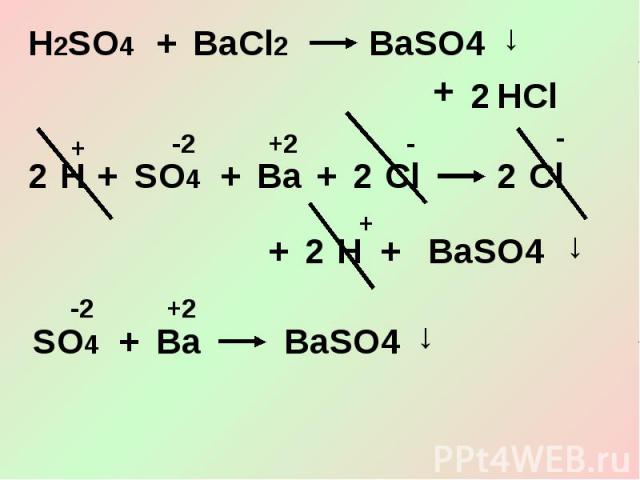Презентация на тему: Реакции ионного обмена

реакции ионного обмена

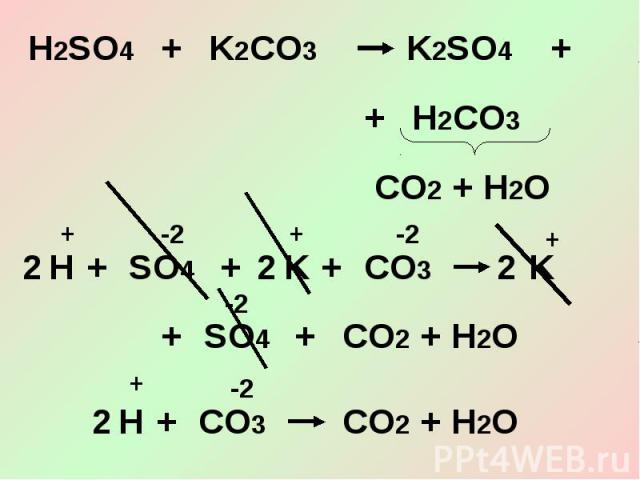
1. Простые вещества, газы, оксиды, нерастворимые соединения не диссоциируют (в ионных уравнениях их записывают в молекулярном виде).

2. Малорастворимые вещества в левой части уравнения записывают в виде ионов, а в правой части – в молекулярном виде (т. е. считают нерастворимыми).

3. Общая сумма зарядов ионов в левой части уравнения должна быть равна общей сумме зарядов ионов в правой части.

4. Реакции ионного обмена идут до конца, если образуется: а) осадок (↓); б) газ (↑); в) малодиссоциирующее вещество (Н.,М.).

Последовательность действий1. Записать уравнение реакции в молекулярном виде, выставить коэффициенты

Последовательность действий2. Используя таблицу растворимости определить растворимость каждого вещества

Последовательность действий3. Составить полное ионное уравнение, записав электролиты в виде ионов, неэлектролиты в молекулярном виде
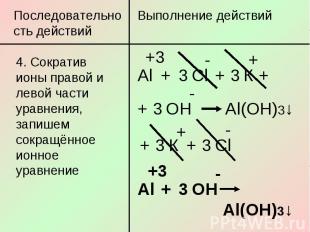
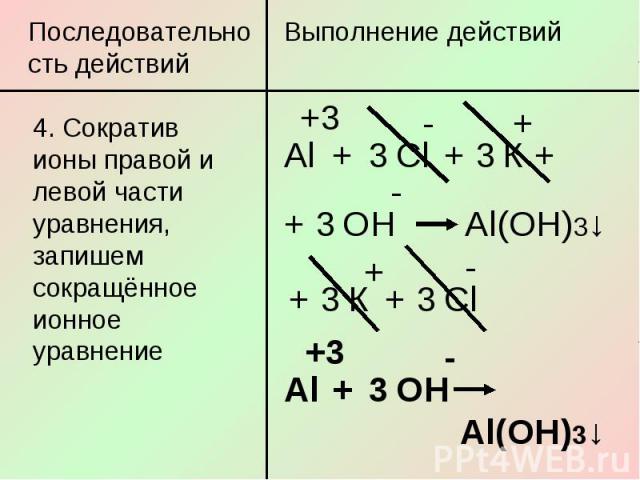
Последовательность действий4. Сократив ионы правой и левой части уравнения, запишем сокращённое ионное уравнение

Реакций, характеризующих общие химические свойства кислот. 1. Кислоты взаимодействуют с металлами, расположенных в ряду электрохимического ряда напряжения до водорода.
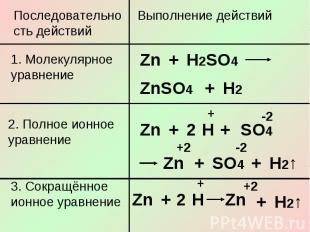
Последовательность действий1. Молекулярное уравнение2. Полное ионное уравнение3. Сокращённое ионное уравнение
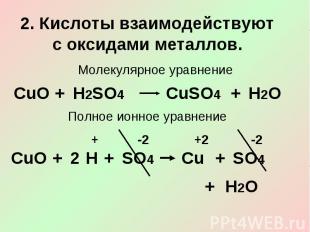
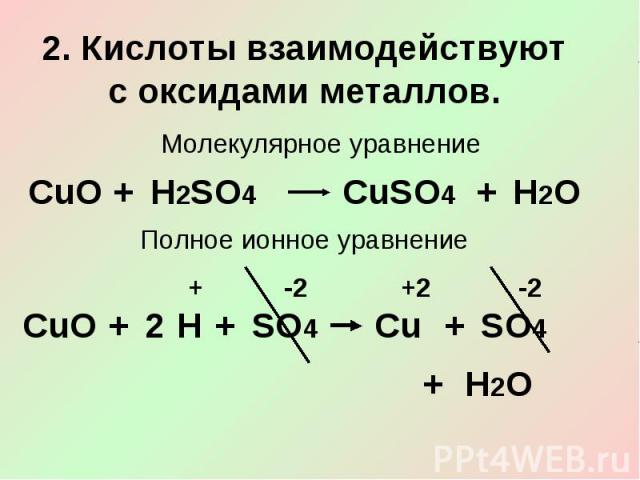
2. Кислоты взаимодействуют с оксидами металлов.Молекулярное уравнениеПолное ионное уравнение

Сокращённое ионное уравнение3. Кислоты взаимодействуют с основаниями (гидроксидами) – реакции нейтрализации.
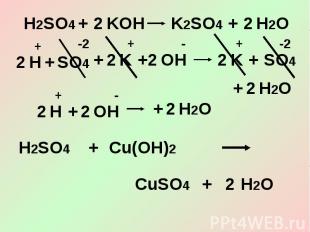
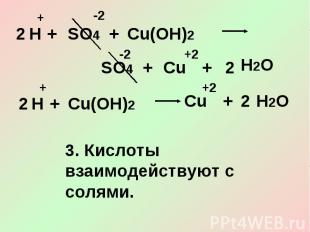
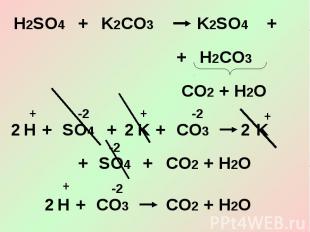
3. Кислоты взаимодействуют с солями.
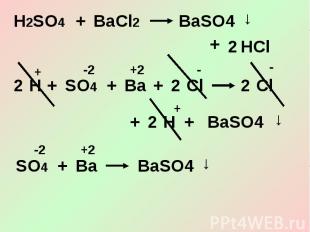

Задания для самоконтроля1. Напишите молекулярные, ионное и сокращенные ионные уравнения реакций между растворами:а) серной кислоты и нитрата бария б) гидроксида калия и фосфорной кислоты

в) карбоната натрия и нитрата свинца(II)г) нитрата меди(II) и гидроксида натрияд) карбоната калия и азотной кислотые) гидроксида лития и сульфата железа(III)

ж) нитрата серебра и хлорида алюминия