Презентация на тему: Металлы в природе. Общие способы их получения

Металлы в природе. Общие способы их получения

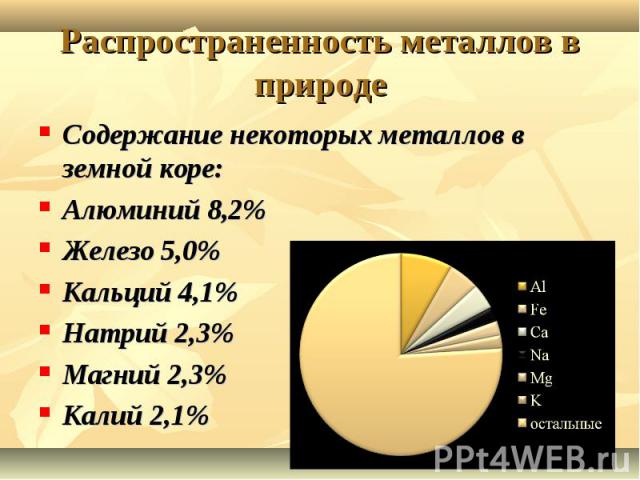
Распространенность металлов в природе Содержание некоторых металлов в земной коре:Алюминий 8,2%Железо 5,0%Кальций 4,1%Натрий 2,3%Магний 2,3%Калий 2,1%

Распространенность металлов в природе Содержание некоторых металлов в морской воде:Na+ 1,05%Mg 2+ 0,12%

В природе металлы могут встречаться Только в свободном (самородном) виде (благородные металлы - золото, платина);В самородном виде и в виде соединений (металлы малой активности – серебро, медь, ртуть, олово);Только в виде соединений (металлы, стоящие в ряду напряжений до олова).




Железный метеорит



Чаще всего металлы встречаются в виде Солей неорганических кислотОксидов

Сульфиды Галенит PbS Киноварь HgSПирит FeS2И др.

Хлориды Сильвин KClГалит NaClСильвинит KCl • NaClКарналлит KCl • MgCl2 • 6H2OИ др.
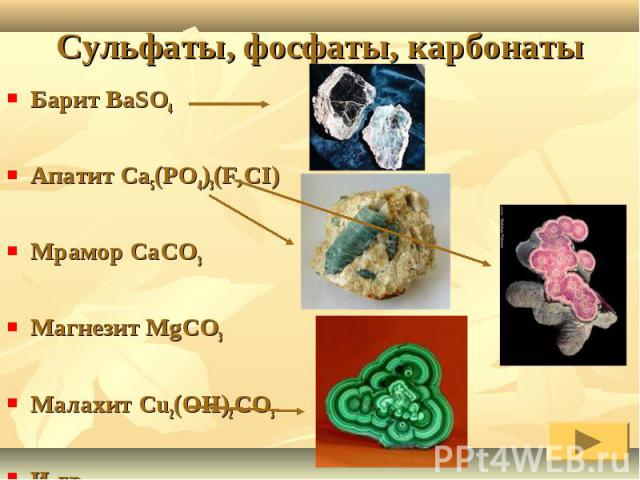
Барит BaSO4Апатит Ca5(PO4)3(F,CI) Мрамор CaCO3Магнезит MgCO3Малахит Cu2(OH)2CO3И др.

Магнетит Fe3O4Гематит Fe2O3Каолин Al2O3 • 2SiO2 • 2H2OИ др.

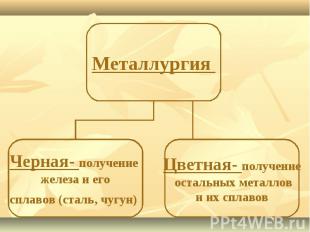
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.Отрасль промышленности, занимающаяся получением металлов из руд, называется металлургией.

1. Пирометаллургия Восстановление металлов из руд при высоких температурах с помощью восстановителей.Соль → оксид Соли кислородсодержащих кислот – термическое разложение:CuCO3 = CuO + CO2Соли бескислородных кислот- обжиг:2ZnS + ЗО2 = 2ZnО + 2SО2

Восстановление углем или угарным газом:CuO + C → Cu + COCuO + CO → Cu + CO2Водородотермия:Cr2O3 + H2 → Cr + H2OМеталлотермия:Fe2O3 + Al → Fe + Al2O3

2. Гидрометаллургия Получение металлов из растворов их солей.Перевод нерастворимого соединения в раствор:CuO + H2SO4 = CuSO4 + H2OВосстановление металла из раствора: CuSO4 + Fe = FeSO4 + Cu.

Электрометаллургия – это способы получения металлов с помощью электрического тока (электролиза). 2NaCl → 2Na + Cl2MgBr2 → Mg + Br2Микробиологические методы получения металлов.

§ 9, упражнение № 4, 5 письменно.