Презентация на тему: Ионные уравнения

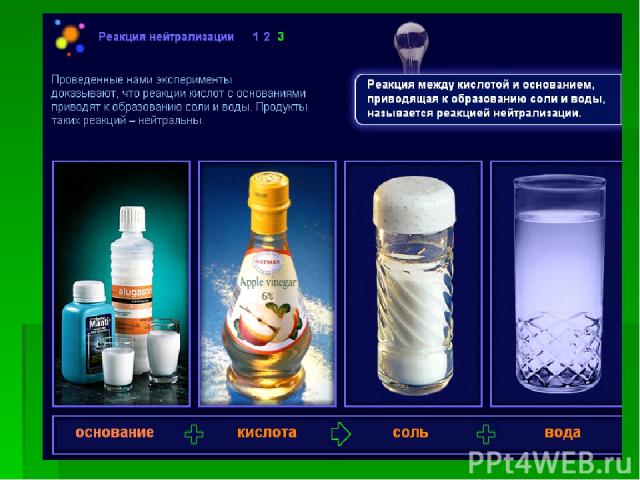
Тема: Ионные уравнения реакции Вспомним реакцию нейтрализации.

Протекающая реакция описывается следующим уравнением 2KOH + H2SO4 = K2SO4 + 2H2O

2KOH + H2SO4 = K2SO4 + 2H2O Отражает ли эта запись в истинном свете проведенную реакцию? Разве в растворе есть молекулы KOH, H2SO4 и K2SO4 - ведь это электролиты? Что же в действительности произошло?

В растворе ионы 2KOH = 2K+ + 2OH- H2SO4 = 2H+ + SO42- K2SO4 = 2K+ + SO42-

Поэтому реакция записывается в ионном виде 2K+ +2OH- +2H+ +SO42- = = 2K+ + SO42- + 2H2O а сущность H+ + OH- = H2O


Реакция нейтрализации между H2SO4 и Ba(OH)2 это другая реакция, так как в результате образуется нерастворимая соль BaSO4

Молекулярное уравнение H2SO4 + Ba(OH)2 = = BaSO4↓ + 2H2O Ионный вид 2H+ + SO42- + Ba2+ + 2OH- = =BaSO4↓ + H2O

Проделаем реакцию между карбонатом калия и соляной кислотой.

Что мы наблюдаем ?

Запишем уравнение реакции. Проверим.

Молекулярное уравнение K2CO3 + 2HCl = 2KCl + H2O + CO2↑ Полный ионный вид 2K+ + CO32- + 2H+ + 2Cl- = = 2K+ + 2Cl- + H2O + CO2 ↑ Краткий ионный вид CO32- + 2H+ = H2O + CO2↑

Правила составления ионных уравнений реакции Сильные электролиты записывают в виде образующих их ионов ( с учетом индексов и коэффициентов).

Формулы слабых электролитов ( в т.ч. H2O ), нерастворимых и газообразных веществ записываются в молекулярной форме

Если вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз ( ↓ ); а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх ( ↑ ).

Проделаем реакцию между сульфатом меди(2) и гидроксидом натрия.

Что мы наблюдаем ?

Запишем уравнение реакции. Проверим.

Молекулярное уравнение: CuSO4 + 2NaOH = = Cu(OH)2↓ + Na2SO4 Полное ионное уравнение: Cu2+ + SO42- + 2Na+ + 2OH- = = Cu(OH)2↓ + 2Na+ + SO42- Сокращенное ионное уравнение: Cu2+ + 2OH- = Cu(OH)2↓

Реакции ионного обмена в растворах электролитов практически осуществимы (протекают до конца) только в тех случаях, когда в результате реакции образуется осадок, газ или малодиссоциирующее вещество.

Тестовый контроль № 1 Дополните. Частицы заряженные положительно называются ________________________________ Частицы заряженные отрицательно называются _____________________________

№ 2 Продукты реакции нейтрализации 1. Соль и вода 2. Соль и основание 3. Соль и кислота

№ 3 Реакция ионного обмена, идущая до конца 1. MgSO4 + Ba(NO3)2 → 2. MgCl2 + Ba(NO3)2 →

№ 4 Внимательно рассмотрите перечисленные в задании схемы электролитической диссоциации. На какие три равные группы их можно разделить? Назовите каждую группу: а) Ca(OH)2 → → Ca2+ + 2OH- б) Ca(NO3)2 → → Ca2+ + 2NO3- в) HNO3 → H+ + NO3- г) HCl → H+ + Cl- д) KOH → K+ + OH- е) Al2(SO4)3 → → 2Al3+ + 3SO42-

№ 5 Внимательно рассмотрите перечисленные в задании схемы электролитической диссоциации. На какие две равные группы их можно разделить? Назовите каждую группу: а) NaOH → Na+ + OH- б) Ba(NO3)2 → Ba2+ + 2NO3- в) Ba(OH)2 → Ba2+ + 2OH- г) NaCl → Na+ + Cl- д) BaCl2 → Ba2+ + 2Cl- е) Na2CO3 → 2Na+ + CO32-

Ответы № 1 Частицы заряженные положительно называются Катионы Частицы заряженные отрицательно называются Анионы № 2 1. Соль и вода

№ 3 1. MgSO4 + Ba(NO3)2 → № 4 1-я группа (схемы электролитической диссоциации щелочей) : а) Ca(OH)2 →Ca2+ +2OH- д) KOH→K++OH- 2-я группа (схемы электролитической диссоциации кислот) : г) HCl → H+ + Cl- в) HNO3 → H+ + NO3- 3-я группа (схемы электролитической диссоциации солей) : б) Ca(NO3)2 → Ca2+ + 2NO3- е) Al2(SO4)3 → → 2Al3+ + 3SO42-

№ 5 1-я группа (схемы электролитической диссоциации соединений натрия) : а) NaOH → Na+ + OH- г) NaCl → Na+ + Cl- е) Na2CO3 → 2Na+ + CO32- 2-я группа (схемы электролитической диссоциации соединений бария) : б) Ba(NO3)2 → Ba2+ + 2NO3- в) Ba(OH)2 → Ba2+ + 2OH- д) BaCl2 → Ba2+ + 2Cl-

Домашнее задание § 37, упр 1 - 5