Презентация на тему: Кислоты (8 класс)

Кислоты Учитель химии МБОУ СОШ №7 г.Дубна Миронова Е.А.

Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Классификация H2SO4 серная HCl соляная

Физические свойства кислот Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.

Способы получения кислот 1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl 2. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 3. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
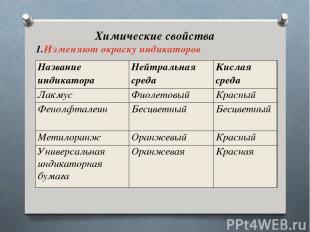
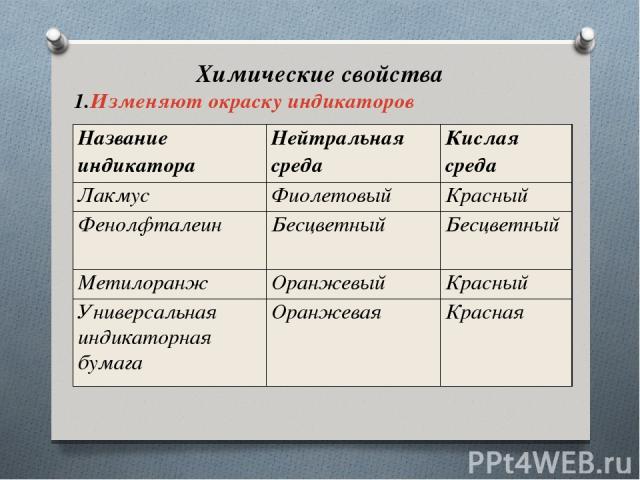
Химические свойства Изменяют окраску индикаторов Название индикатора Нейтральная среда Кислая среда Лакмус Фиолетовый Красный Фенолфталеин Бесцветный Бесцветный Метилоранж Оранжевый Красный Универсальная индикаторная бумага Оранжевая Красная

2. Взаимодействуют с металлами в ряду активности до H2 Zn + 2 HCl = ZnCl2 + H2 3. Взаимодействуют с оксидами металлов CuO + H2SO4 = Cu SO4 + H2O 4. Взаимодействуют с гидроксидами металлов H3PO4 + 3NaOH = Na3PO4 + 3H2O 5. Взаимодействуют с солями, если образуется газ или осадок BaCl2 + H2SO4 = BaSO4↓ + 2HCl CaCO3 + 2HCl = CaCl2 + CO2 ↑ +H2O

Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду: H2CO3 ↔ H2O + CO2↑ H2SO3 ↔ H2O + SO2↑ Сероводородная кислота в продуктах выделяется в виде газа: СаS + 2HCl = H2S↑ + CaCl2

Задания для закрепления Составьте уравнения реакций: Ca + HCl= H2SO4+ Na= Al + H2S= H3PO4+ Ca= H2CO3+ Na2O= ZnO + HCl= HNO3+ CaO= Fe2O3 + H2SO4=