Презентация на тему: Химия металлы

Кириллова Маргарита Алексеевна учитель химии лицея № 369 Красносельского района 900igr.net

Положение металлов в Периодической системе Строение атомов Кристаллические решётки Общие физические свойства Металлы в природе Способы получения металлов Химические свойства металлов

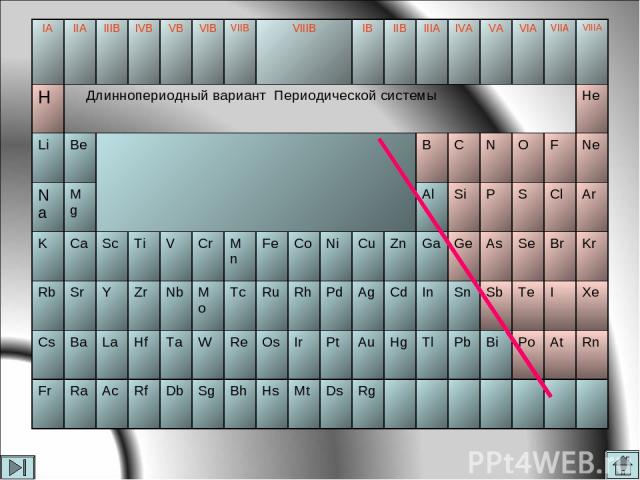
IA IIA IIIB IVB VB VIB VIIB VIIIB IB IIB IIIA IVA VA VIA VIIA VIIIA H Длиннопериодный вариант Периодической системы He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg

К металлам относятся простые вещества, которые образуют:
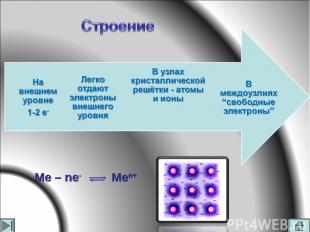
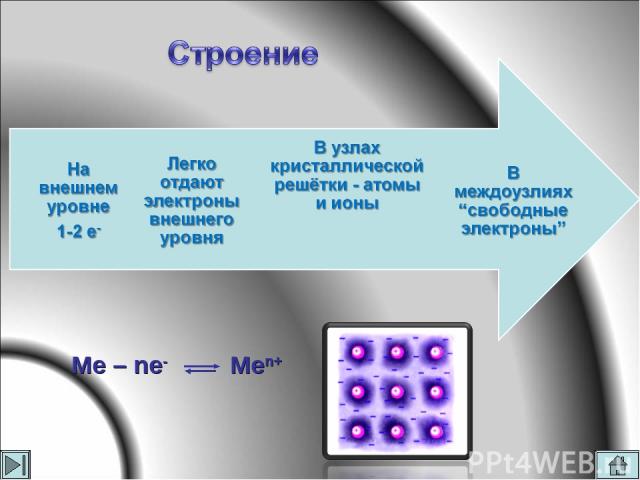
Ме – ne- Men+
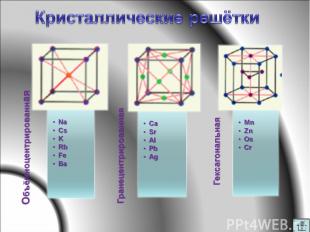

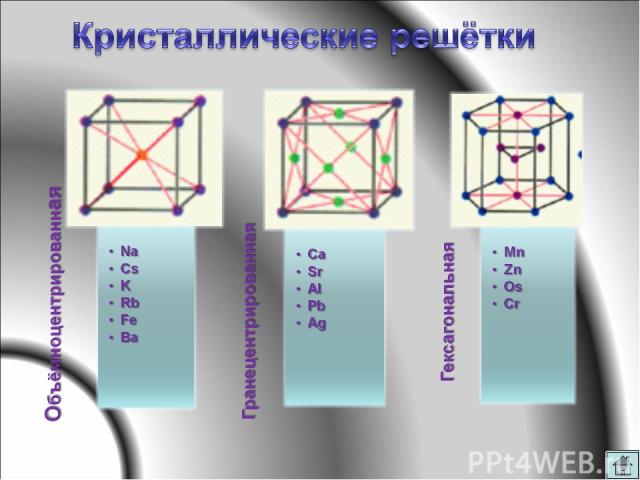
Все твердые, кроме ртути Металлический блеск Пластичность, ковкость Электропроводность Теплопроводность Высокие температуры плавления

Самый распространённый металл в природе - алюминий - более 8% от земной коры



Получение металлов из руд их восстановлением. Восстановители:

Получение металлов электролизом:

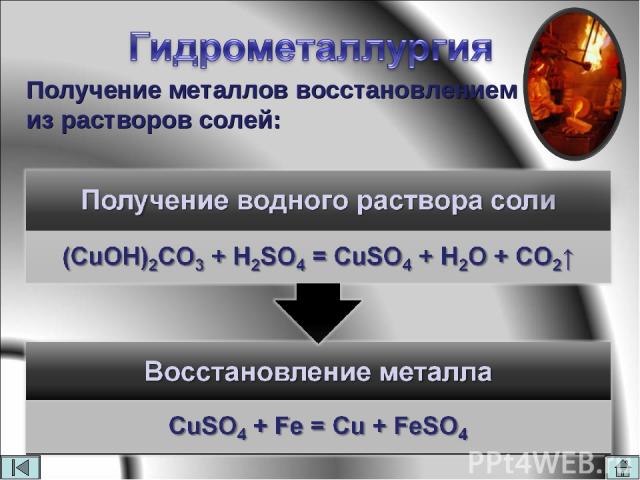
Получение металлов восстановлением из растворов солей:

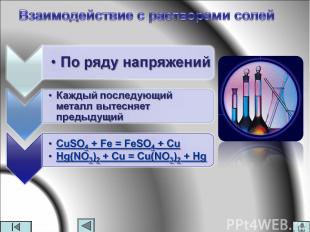
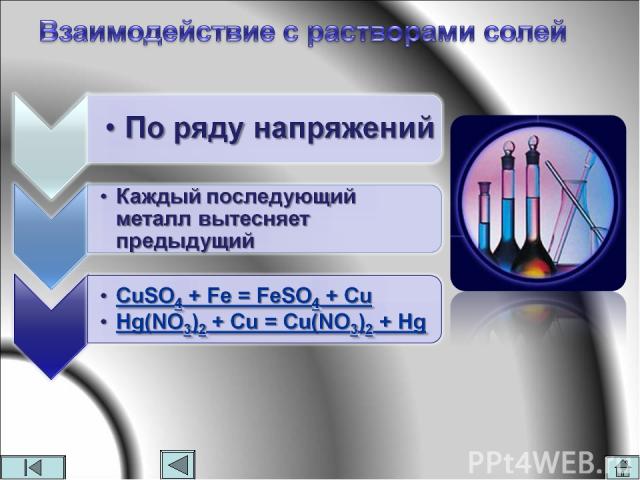
Металлы - восстановители Ме0 – ne- = Men+ процесс окисления С простыми веществами-неметаллами С водой С кислотами С растворами солей Они взаимодействуют:


2K + 2H2O = 2KOH + H2↑ Zn + 2H2O = ZnO + H2↑ 3Fe + 4H2O = Fe3O4 + 4H2↑
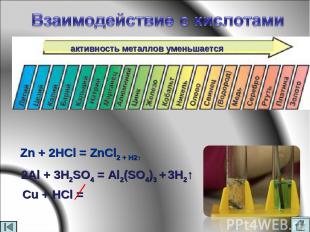
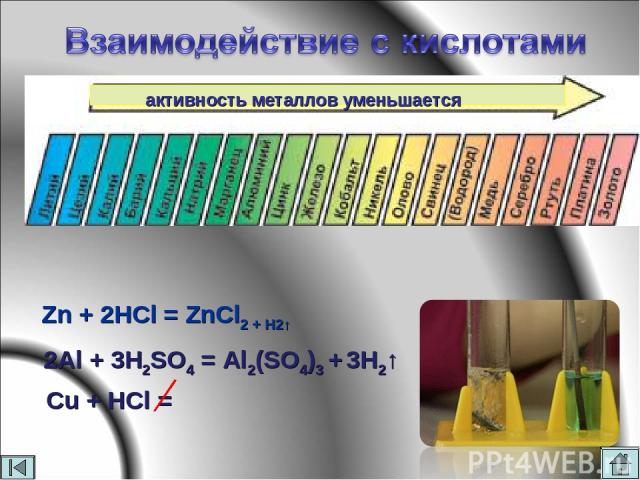
Zn + 2HCl = ZnCl2 + H2↑ 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ Cu + HCl = активность металлов уменьшается