Презентация на тему: Химия железа

Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе 900igr.net

Почему из такого количества металлов побочных подгрупп для изучения выбрали один- именно железо ? Наиболее широко используется в современной промышленности. Велика его распространенность в природе. Важен с биологической точки зрения.
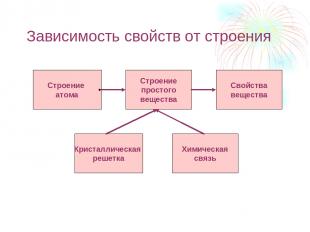
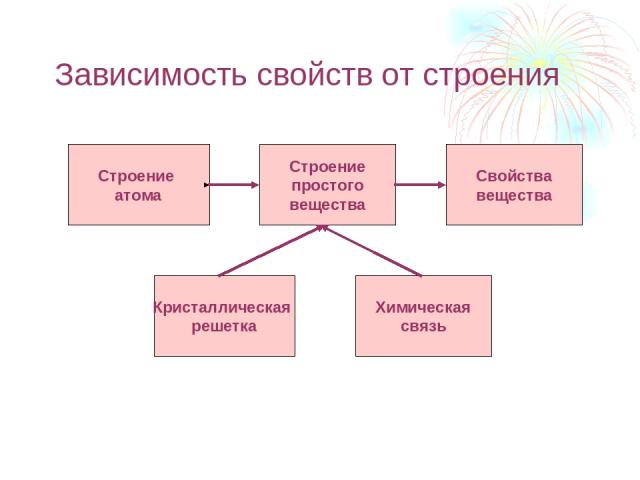
Зависимость свойств от строения Строение атома Строение простого вещества Свойства вещества Кристаллическая решетка Химическая связь
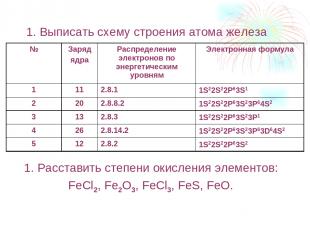
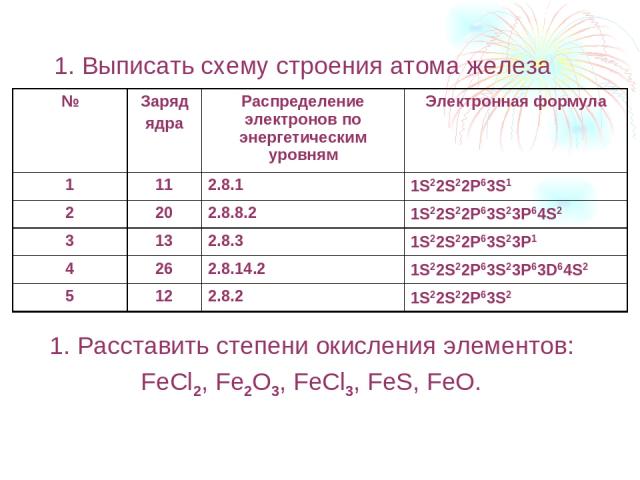
1. Выписать схему строения атома железа 1. Расставить степени окисления элементов: FeCl2, Fe2O3, FeCl3, FeS, FeO. № Заряд ядра Распределение электронов по энергетическим уровням Электронная формула 1 11 2.8.1 1S22S22P63S1 2 20 2.8.8.2 1S22S22P63S23P64S2 3 13 2.8.3 1S22S22P63S23P1 4 26 2.8.14.2 1S22S22P63S23P63D64S2 5 12 2.8.2 1S22S22P63S2

ответы № 26 2.8.14.2. 1S22S22P63S23P63D64S2 Fe+2Cl2-1 , Fe2+3O3-2 , Fe+3Cl3-1 , Fe+2S-2 , Fe+2O-2 .
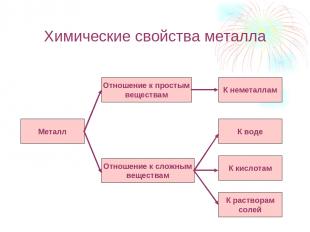
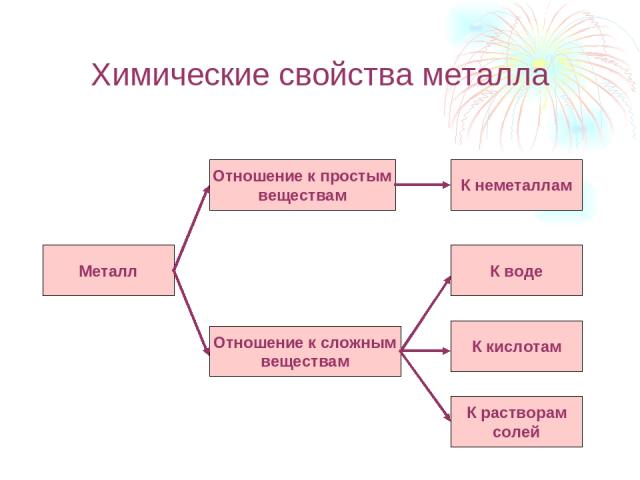
Химические свойства металла Металл Отношение к простым веществам Отношение к сложным веществам К неметаллам К воде К кислотам К растворам солей

Взаимодействие железа с простыми веществами Fe0 + S0 = Fe+2S-2 2Fe0 + 3Cl20 = 2Fe+3Cl3-1 3Fe0 + 2O20= Fe+2O-2 + Fe2+3O3-2 (Fe3O4)

Взаимодействие железа со сложными веществами 3Fe0 + 4H2O = Fe3O4 + H20 ( Fe+2O-2 + Fe2+3O3-2 ) Fe0 + 2H+1Cl = Fe+2Cl2 + H20 Fe0 + Cu+2Cl2 = Fe+2Cl2 + Cu0

Тест- тренажер 1.У этого металла последние электроны заполняют не внешний, а предвнешний энергетический уровень. 2.Этот металл относится к S-элементам. 3. На внешнем энергетическом уровне этого металла 2 электрона. 4. Для этого металла характерна постоянная степень окисления. 5. Это один из самых легких и мягких металлов. 6. Этот металл проявляет восстановительные свойства в реакциях. 7. Этот металл не взаимодействует с растворами солей. 8. При взаимодействии с серой этот металл приобретает степень окисления +2. 9. Этот металл вытесняет водород из соляной и разбавленной серной кислоты. 10. Этот металл относится к d-элементам. 11. Этот металл образует металлическую кристаллическую решетку и металлическую связь. 12. На внешнем энергетическом уровне у атома этого металла 3 электрона. 13. Для этого металла характерна переменная степень окисления. 14. Этот металл обладает сильными магнитными свойствами. 15. Этот металл при взаимодействии с кислородом образует смесь оксидов МеО и Ме2О3 16. При взаимодействии с хлором этот металл приобретает степень окисления +3 17. Этот металл не взаимодействует с концентрированной серной и азотной кислотами при нормальных условиях. 18. Это серебристо- серый металл, ковкий и пластичный, с температурой плавления 15390С. .