Презентация на тему: ГИДРОЛИЗ СОЛЕЙ 11 класса

* Презентация к уроку по теме «ГИДРОЛИЗ СОЛЕЙ» для обучающихся 11 класса
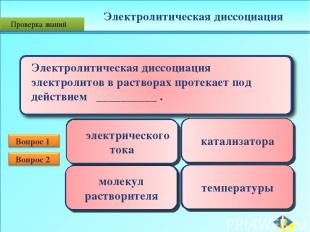
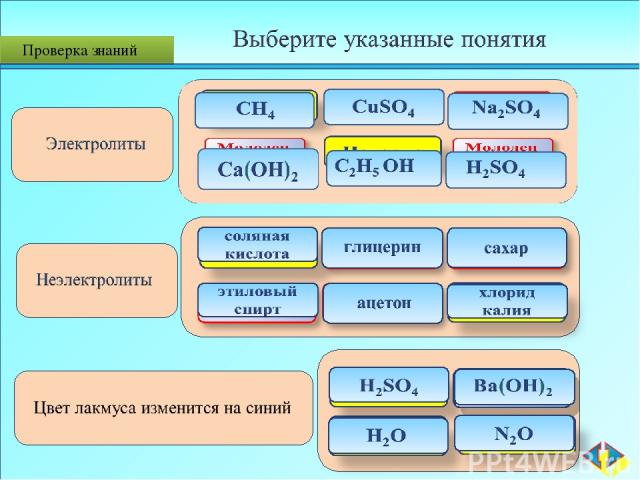
атомы ионы молекулы электроны электрического тока катализатора молекул растворителя температуры Электролитическая диссоциация Проверка знаний
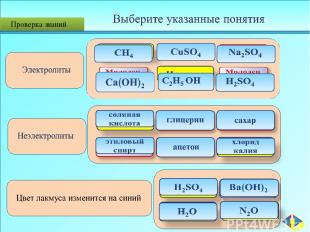
Проверка знаний
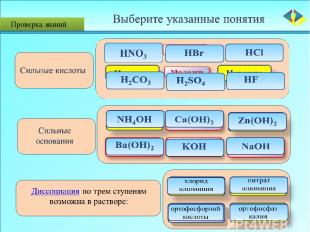
Проверка знаний
![Проверка знаний [H+] [H+] ↔ [OH-] нейтральная кислая щелочная [H+] = [OH-] [H+] Проверка знаний [H+] [H+] ↔ [OH-] нейтральная кислая щелочная [H+] = [OH-] [H+]](https://fs3.ppt4web.ru/images/132003/184943/310/img4.jpg)
Проверка знаний [H+] [H+] ↔ [OH-] нейтральная кислая щелочная [H+] = [OH-] [H+] > [OH-] [H+] < [OH-] [H+] =10-7 моль/л [H+] 10-7 моль/л = 7 < 7 > 7 Вода - слабый электролит Н2О ⇄ Н+ + ОН- Типы сред Среда раствора

Что такое гидролиз? Гидролиз соли – процесс ионообменного взаимодействия ионов соли с молекулами воды, в результате которого образуются слабо диссоциирующие молекулы или ионы. Слово «гидролиз» означает разложение водой («гидро» - вода,«лизис» - разложение). Любую соль можно рассматривать как продукт, образованный взаимодействием соответствующих основания и кислоты. Объяснение материала

Сущность процесса гидролиза солей Возможно три типа гидролиза: гидролиз по катиону (в реакцию с водой вступает только катион); гидролиз по аниону (в реакцию с водой вступает только анион); совместный гидролиз - гидролиз по катиону и по аниону (в реакцию с водой вступает и катион, и анион). Гидролиз – это взаимодействие катионов или анионов соли с гидроксид-ионами ОН– или ионами водорода Н+ из молекул воды. Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного , труднорастворимого или летучего продукта.

Типы гидролиза

Гидролиз солей, образованных слабым основанием и сильной кислотой. NH4NO3 NH4+ NO3– H2O O H – + + H+ Ионы NH4+ и OH– связываются, образуя слабое малодиссоциированное соединение гидроксид аммония NH4OH и вызывая смещение равновесия диссоциации воды в сторону увеличения концентрации H+.

Уравнение реакции гидролиза нитрата аммония NH4NO3 H2O + NH4OH + HNO3 В ионной форме: NH4+ + NO3– + H2O NH4OH + H+ + NH4+ + H2O NH4OH + H+ Реакция среды при гидролизе соли, образованной слабым основанием и сильной кислотой, – кислая ( рН

Гидролиз карбоната натрия Na2CO3. В водном растворе: Ионы CO32- и H+ связываются, образуя слабую малодиссоциированную угольную кислоту и вызывая смещение равновесия диссоциации воды вправо, в сторону увеличения концентрации OH–. Na2CO3 CО32- + Na+ H2O H+ + OH– Гидролиз солей, образованных сильным основанием и слабой кислотой.

Na2CO3 + H2O NaHCO3 + CO32- + 2Na+ + H2O Na+ + HCO3- + Na+ + CO32- + H2O HCO3- OH– + Уравнение реакции гидролиза карбоната натрия: Реакция среды при гидролизе соли, образованной сильным основанием и слабой кислотой, – щелочная.(pH>7). Na OH OH– Фенолфталеин окрашивается в малиновый цвет В молекулярной форме: В ионной форме:

NaOH Na + Na+ HOH OH- (pH = 7) NaCl + HOH гидролизу подвергаться не будет, потому что катионы и анионы соли не связываются с ионами Н+ или ОН- воды. В этом случае не образуется слабый электролит. Среда растворов этих солей – нейтральная (рН=7), так как концентрации ионов Н+ и ОН- в их растворах равны, как в чистой дистиллированной воде. Индикаторы окраску не изменяют. Соль, образованная сильным основанием и сильной кислотой: + HCl + HOH Cl- + + Cl- OH- H+ + + + H+

CH3COONH4 CH3COO– + NH4+ H2O O H– H+ + Гидролиз солей, образованных слабым основанием и слабой кислотой. В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.

Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Кдис.(NH4OH) = Кдис.(CH3COOH) (Кдис.NH4OH =1.8∙10-5; Кдис.CH3COOH =1.8∙10-5). Уравнение реакции гидролиза ацетата аммония В молекулярной форме: CH3COONH4 + H2О = CH3COOH + NH4OH Полное ионное уравнение: NH4+ + CH3COO- + H2O = CH3COOH + NH4OH
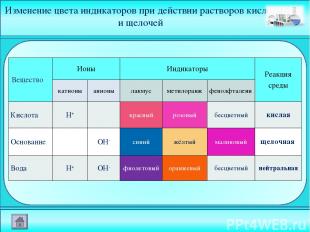
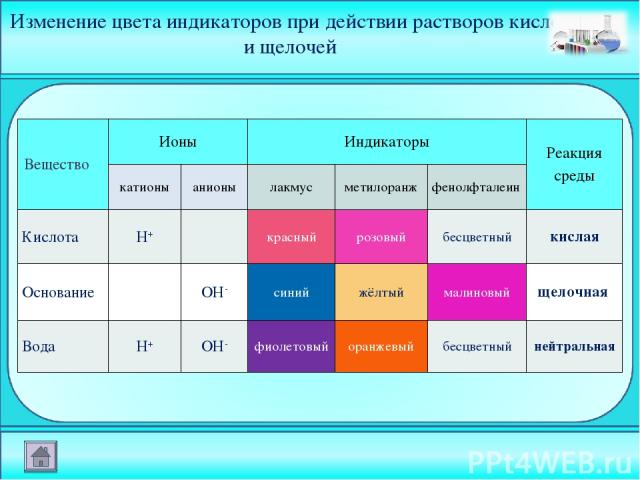
Изменение цвета индикаторов при действии растворов кислот и щелочей Вещество Ионы Индикаторы Реакция среды катионы анионы лакмус метилоранж фенолфталеин Кислота Н+ красный розовый бесцветный кислая Основание ОН- синий жёлтый малиновый щелочная Вода Н+ ОН- фиолетовый оранжевый бесцветный нейтральная

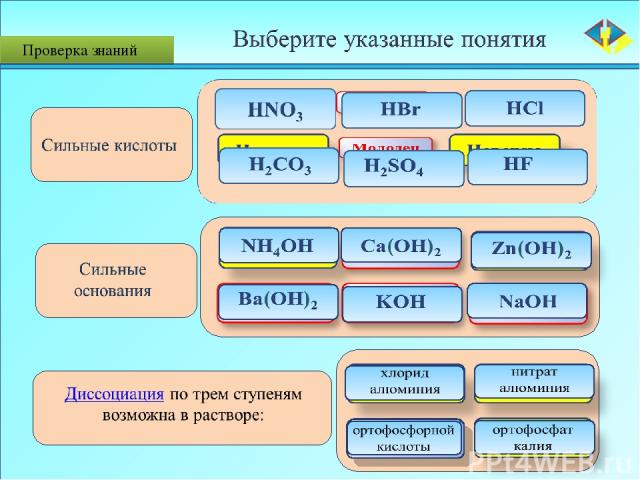
Диссоциация многоосновных кислот
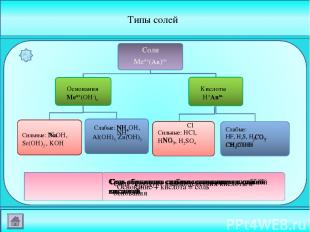
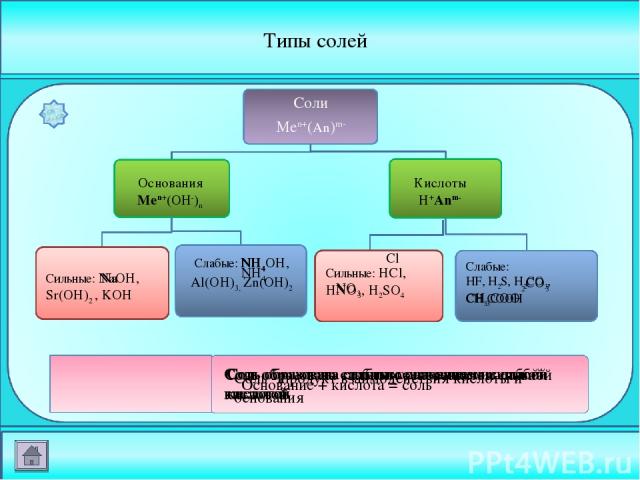
Типы солей Сильные: HCl, HNO3, H2SO4 Сильные: NaOH, Sr(OH)2 , KOH Основания Men+(OH-)n Кислоты H+Anm- Слабые: NH4OH, Al(OH)3, Zn(OH)2 Слабые: HF, H2S, H2CO3, CH3COOH Соли Men+(An)m- Соль - продукт взаимодействия кислоты и основания Основание + кислота = соль Соль образована слабым основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой Соль образована слабым основанием и слабой кислотой Cl Соль образована сильным основанием и сильной кислотой Na NH4 NH4 NO3 Na 2CO3 CH3COO
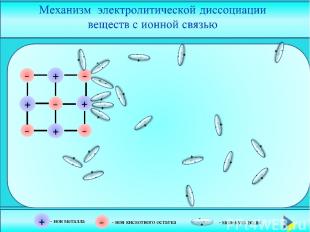
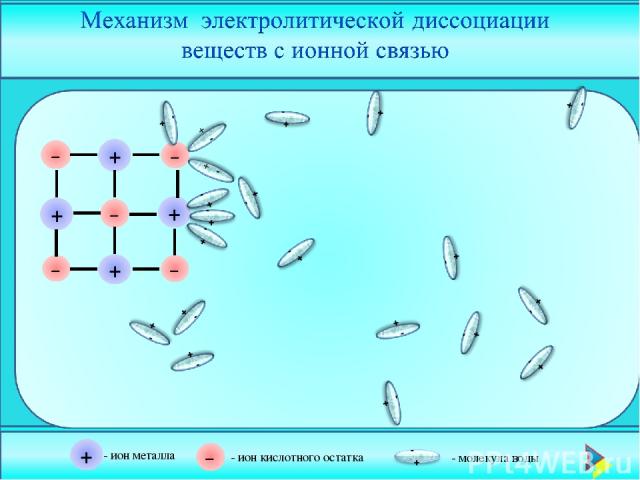
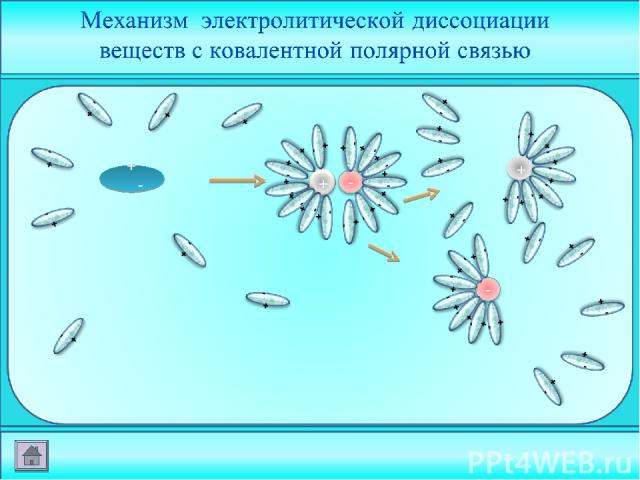
- ион металла - ион кислотного остатка - молекула воды
- +


![Проверка знаний [H+] [H+] ↔ [OH-] нейтральная кислая щелочная [H+] = [OH-] [H+] > [OH-] [H+] < [OH-] [H+] =10-7 моль/л [H+] 10-7 моль/л = 7 < 7 > 7 Вода - слабый электролит Н2О ⇄ Н+ + ОН- Типы сред Среда раствора Проверка знаний [H+] [H+] ↔ [OH-] нейтральная кислая щелочная [H+] = [OH-] [H+] > [OH-] [H+] < [OH-] [H+] =10-7 моль/л [H+] 10-7 моль/л = 7 < 7 > 7 Вода - слабый электролит Н2О ⇄ Н+ + ОН- Типы сред Среда раствора](https://fs3.ppt4web.ru/images/132003/184943/640/img4.jpg)