Презентация на тему: Гидролиз неорганических солей


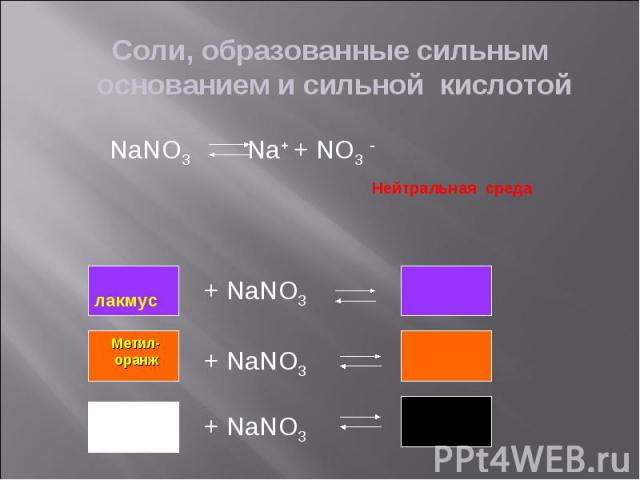
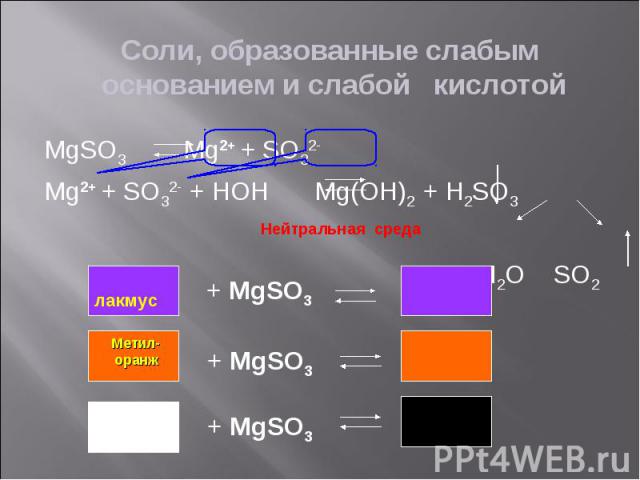
Гидролиз – реакция обмена между растворимыми солями и водой Гидролиз – реакция обмена между растворимыми солями и водой Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие) Слабые кислота – кислоты, являющиеся слабыми электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и другие) Сильные основания – сильные электролиты - щелочи (NaOH, KOH, Ca(OH)2 и другие) Слабые основания – нерастворимые основания, слабые электролиты (Cu(OH)2, Al(OH)3 и другие)
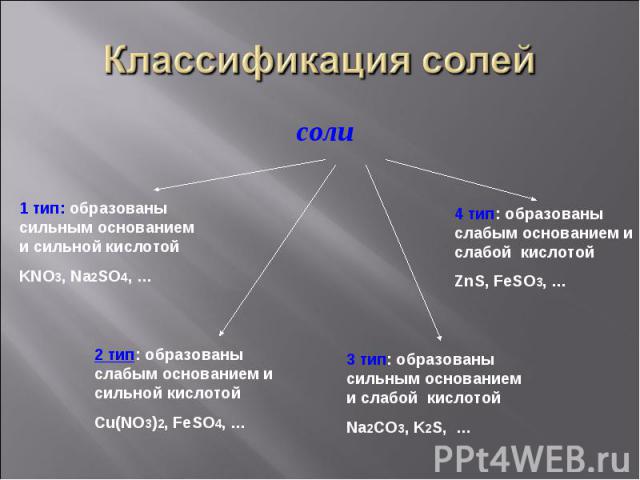
соли соли

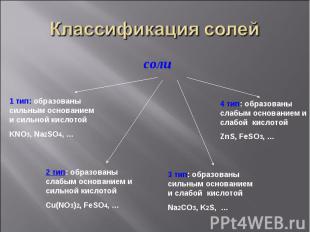
Задание1. Задание1. Разделите предложенные формулы солей на четыре типа, объясните свой выбор: BaCl2, ZnSO4, CuCl2, Na2SO4, Al(NO3)3, MnCl2, Cr2(SO4)3, K2SiO3, LiNO3, Co(NO2)2,MgSO3
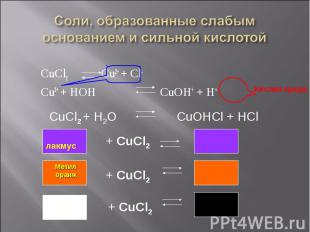
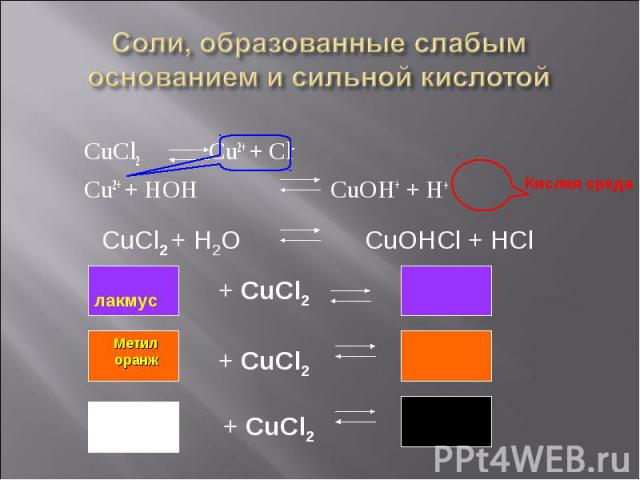
CuCl2 Cu2+ + Cl- CuCl2 Cu2+ + Cl- Cu2+ + HOH CuOH+ + H+

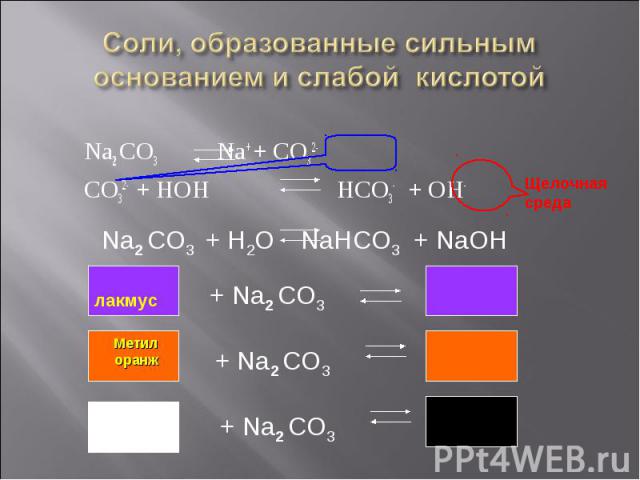
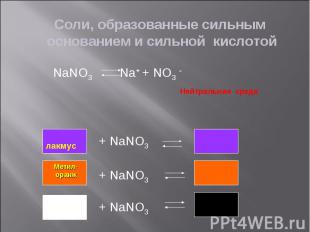
Na2 CO3 Na+ + CO32- Na2 CO3 Na+ + CO32- CO32- + HOH HCO3- + OH-
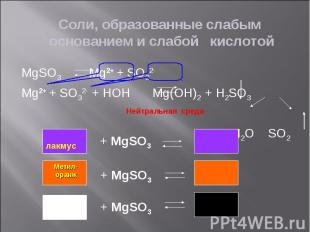

Задание 2: Задание 2: Определите окраску лакмуса в растворах солей: Ba(NO3)2, FeCl3, LiNO2, CoSO4, Na2SiO3, ZnS, KCl Приведите примеры возможных реакций (по одному для каждого типа соли)

Задание 3: Задание 3: Исключите лишнюю соль из списка: А) ZnCl2, CuSO4, KNO3, Ni(NO3)2 Б) K2S, AgNO3, CrCl3, Pb(NO3)2 В) Na2S, CaCl2, Li3PO4, K2CO3 Г) KNO3, MgBr2, Na2SO4, CaI2 Д) SnCl2, Al(NO3)3, PbSO4, Fe2(SO4)3 Напишите уравнения реакций гидролиза выбранных вами солей