Презентация на тему: Хлороводород. Соляная кислота


HCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха. HCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха. Докажем это: М (HCl)= 1+35,5=36,5 г/моль М (воздуха)= 29 г/моль
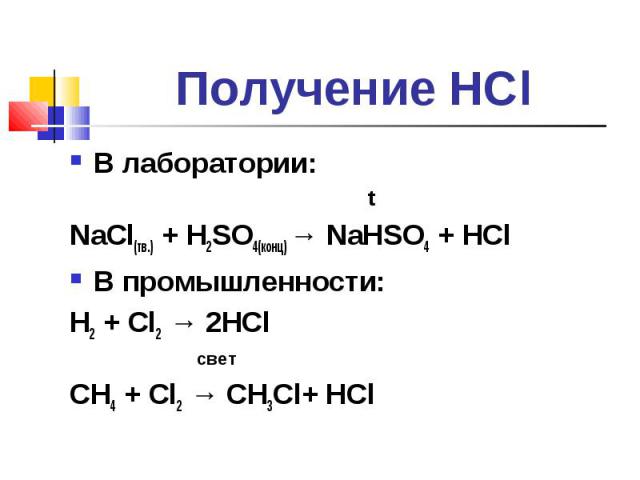
В лаборатории: В лаборатории: t NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl В промышленности: H2 + Cl2 → 2HCl свет CH4 + Cl2 → CH3Cl+ HCl

Соляная кислота сильная, т.е. в водных растворах полностью распадается на ионы: Соляная кислота сильная, т.е. в водных растворах полностью распадается на ионы: HCl → H+ + Cl- Растворы кислоты не имеют запаха.

Кислотные свойства Кислотные свойства А. Взаимодействие с металлами, стоящими в ряду активности до водорода: HCl + Zn → 2HCl + Zn → ZnCl2 + H2 Допишите: HCl + Al →

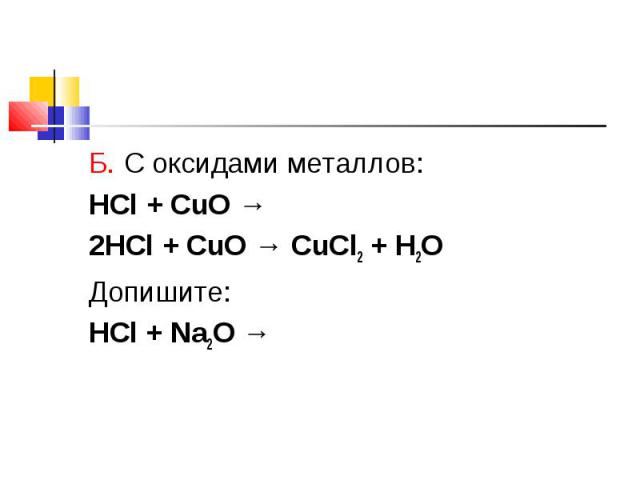
Б. С оксидами металлов: Б. С оксидами металлов: HCl + CuO → 2HCl + CuO → CuCl2 + H2O Допишите: HCl + Na2O →

В. С гидроксидами металлов: В. С гидроксидами металлов: HCl + NaOH → HCl + NaOH → NaCl + H2O Допишите: HCl + Al(OH)3 →

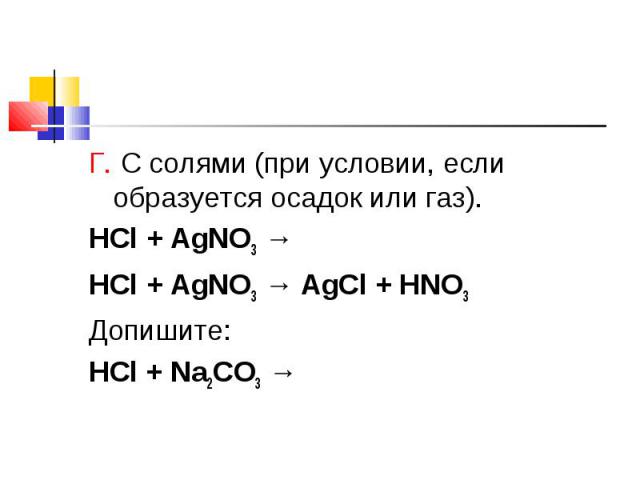
Г. С солями (при условии, если образуется осадок или газ). Г. С солями (при условии, если образуется осадок или газ). HCl + AgNO3 → HCl + AgNO3 → AgCl + HNO3 Допишите: HCl + Na2CO3 →

2. Восстановительные свойства. 2. Восстановительные свойства. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O 16HCl + 2KMnO4 → 2MnCl2 + 5Cl2 + + 2KCl + 8H2O 6HCl + KClO3 → 3Cl2 + KCl + 3H2O