Презентация на тему: Электрохимический ряд напряжений металлов

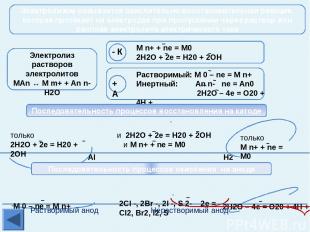
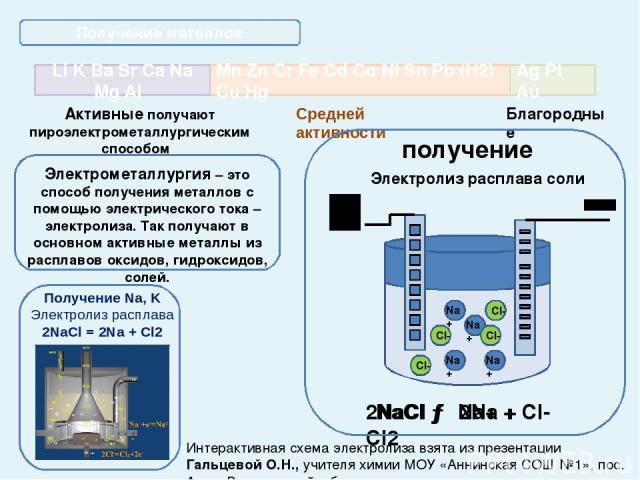
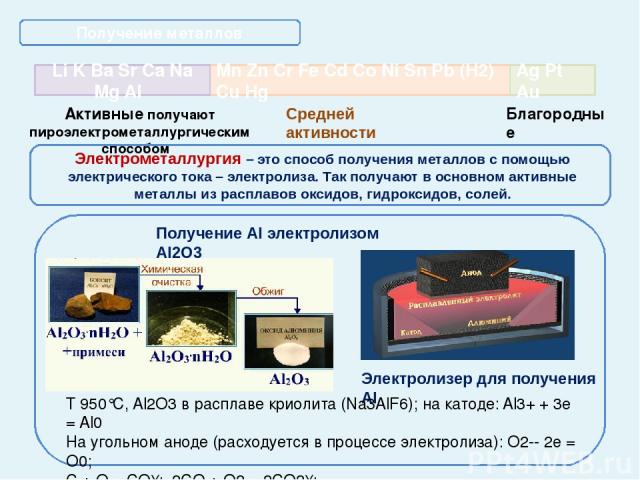
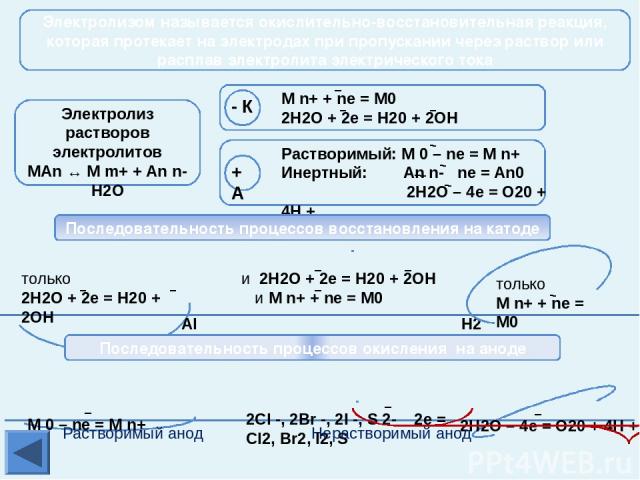
Активные получают пироэлектрометаллургическим способом Благородные Получение металлов Электрометаллургия – это способ получения металлов с помощью электрического тока – электролиза. Так получают в основном активные металлы из расплавов оксидов, гидроксидов, солей. получение Электролиз расплава соли NaCl → Na+ + Cl- 2NaCl → 2Na + Cl2 Интерактивная схема электролиза взята из презентации Гальцевой О.Н., учителя химии МОУ «Аннинская СОШ №1», пос. Анна, Воронежской обл. Mn Zn Cr Fe Cd Co Ni Sn Pb (Н2) Cu Hg Li K Ba Sr Ca Na Mg Al Ag Pt Au Средней активности Получение Na, K Электролиз расплава 2NaCl = 2Na + Cl2 Na+ Na+ Na+ Na+ Cl- Cl- Cl- Cl-
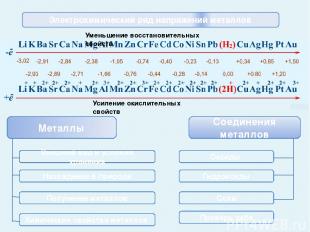
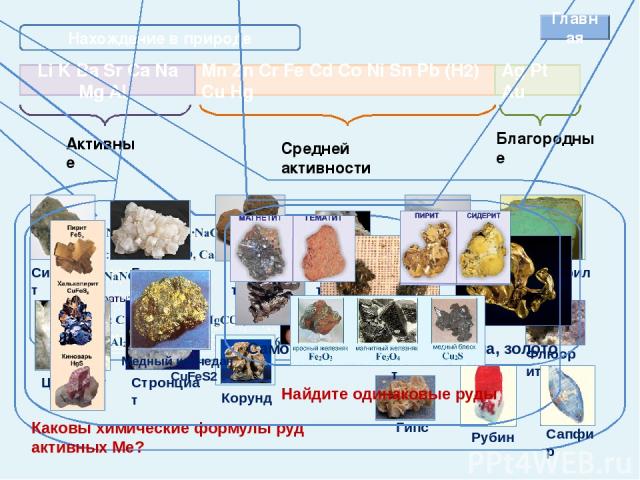
Внешний вид и условия хранения Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb Cu Hg Ag Pt Au

Получение металлов Производство всех остальных Ме и сплавов Уменьшение восстановительных свойств Усиление окислительных свойств
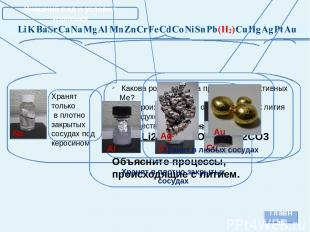
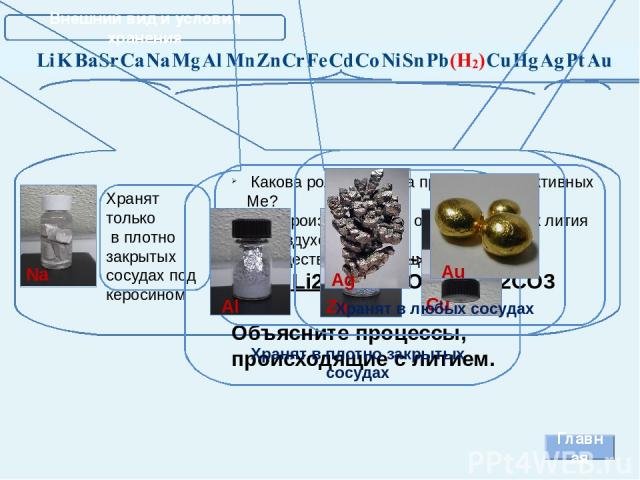
Внешний вид и условия хранения Главная Хранят только в плотно закрытых сосудах под керосином Какова роль керосина при хранении активных Ме? Что произойдет, если оставить кусочек лития на воздухе? Осуществите превращения: Li Li2O LiOH Li2CO3 Объясните процессы, происходящие с литием. Na Хранят в плотно закрытых сосудах Al Zn Cu Ag Au Хранят в любых сосудах
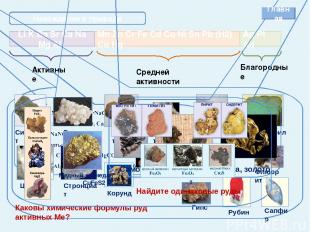
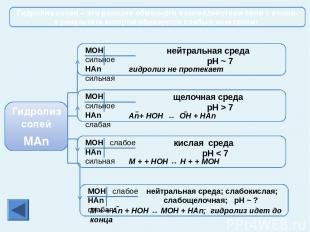
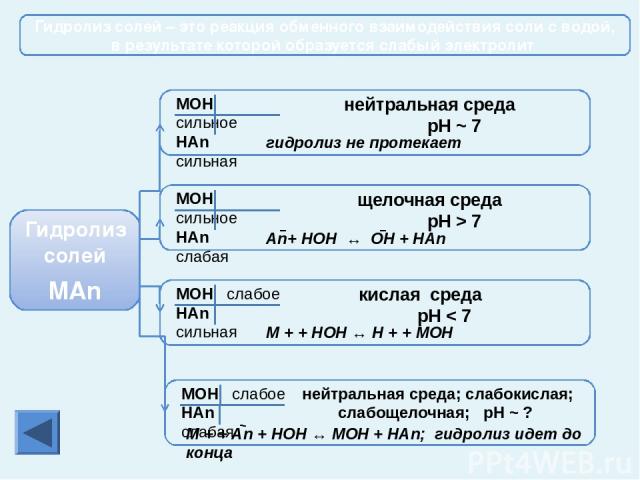
Соединения металлов Оксиды Растворяются в Н2О с образованием щелочей Оксиды не растворяются в воде При нагревании оксиды не разлагаются При t°разлагаются Гидроксиды растворяются в воде Гидроксиды не растворяются в воде Гидроксиды разлагаются в воде Гидроксиды при t° не разлагаются Гидроксиды при t° разлагаются на воду и оксиды При t° разлагаются на Ме, Н2О и О2 Гидроксиды Соли Нитраты при t° разлагаются на нитриты и О2 Нитраты при t° разлагаются на оксид, NO2 и О2 Нитраты при t° разлагаются на Ме, NO2 и О2 Cоли, образованные сильными кислотами не гидролизуются Cоли, образованные сильными кислотами, гидролизуются с образованием кислой среды Cоли, образованные слабыми кислотами гидролизуются (среда щелочная). Существующие и растворимые соли, образованные слабыми кислотами, гидролизуются полностью Гидролиз солей Главная
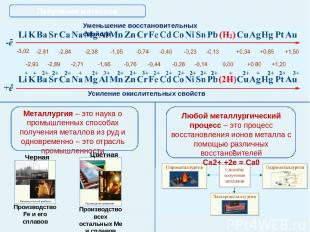
Электрохимический ряд напряжений металлов Уменьшение восстановительных свойств Усиление окислительных свойств Факторы, определяющие положение металла в электрохимическом ряду напряжений: Строение электронной оболочки: число электронных уровней и число электронов на внешнем слое; Прочность кристаллической решетки металла; Энергия процесса гидратации иона (соединения его с водой). Помни! Ряд напряжений характеризует лишь способность М к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях. Главная
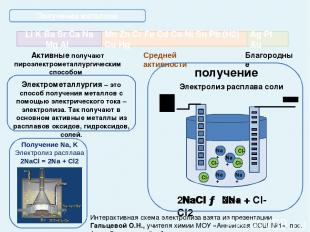
Активные получают пироэлектрометаллургическим способом Благородные Получение металлов T 950°C, Al2O3 в расплаве криолита (Na3AlF6); на катоде: Al3+ + 3e = Al0 На угольном аноде (расходуется в процессе электролиза): O2-- 2e = O0; C + O = CO↑; 2CO + O2 = 2CO2↑; Mn Zn Cr Fe Cd Co Ni Sn Pb (Н2) Cu Hg Li K Ba Sr Ca Na Mg Al Ag Pt Au Средней активности Электрометаллургия – это способ получения металлов с помощью электрического тока – электролиза. Так получают в основном активные металлы из расплавов оксидов, гидроксидов, солей. Электролизер для получения Аl Получение Аl электролизом Аl2O3
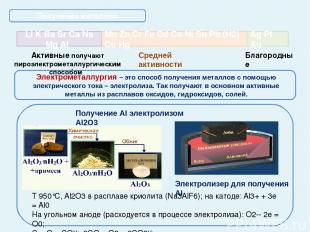
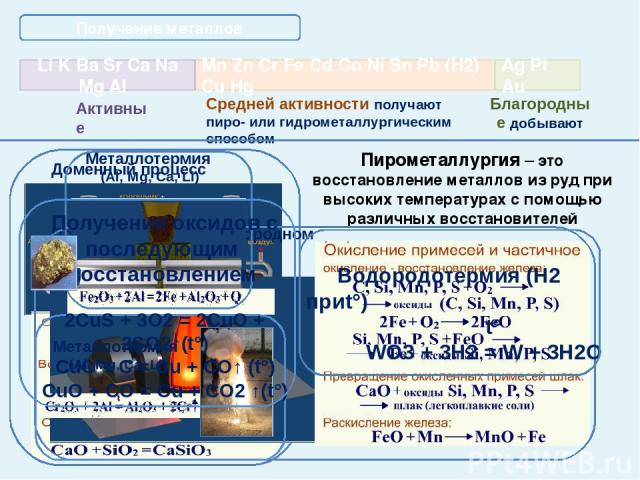
Получение металлов Пирометаллургия – это восстановление металлов из руд при высоких температурах с помощью различных восстановителей Средней активности получают пиро- или гидрометаллургическим способом Благородные добывают Доменный процесс Получение стали в кислородном конвертере Металлотермия (Al, Mg, Ca, Li) Водородотермия (Н2 приt°) t° WO3 + 3H2 = W + 3H2O Получение оксидов с последующим восстановлением 2CuS + 3O2 = 2CuO + 2SO2↑(t°) CuO + C = Cu + CO↑ (t°) CuO + CO = Cu + CO2 ↑(t°)
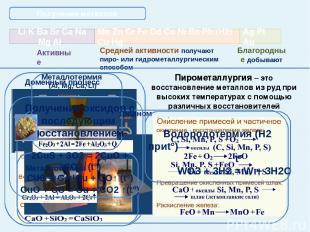
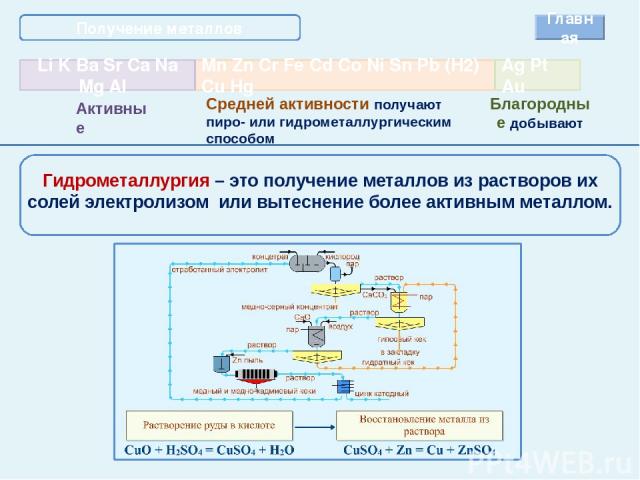
Получение металлов Главная Средней активности получают пиро- или гидрометаллургическим способом Благородные добывают Гидрометаллургия – это получение металлов из растворов их солей электролизом или вытеснение более активным металлом.
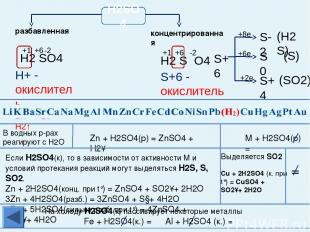
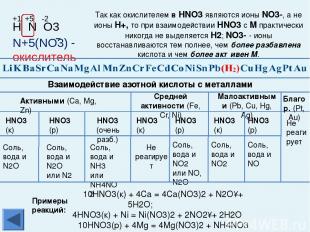
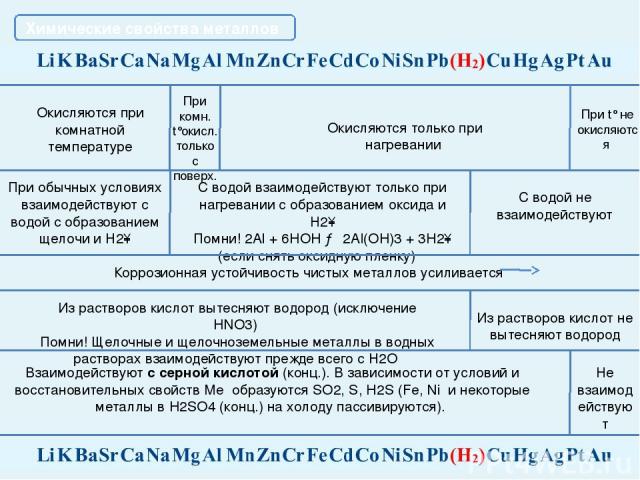
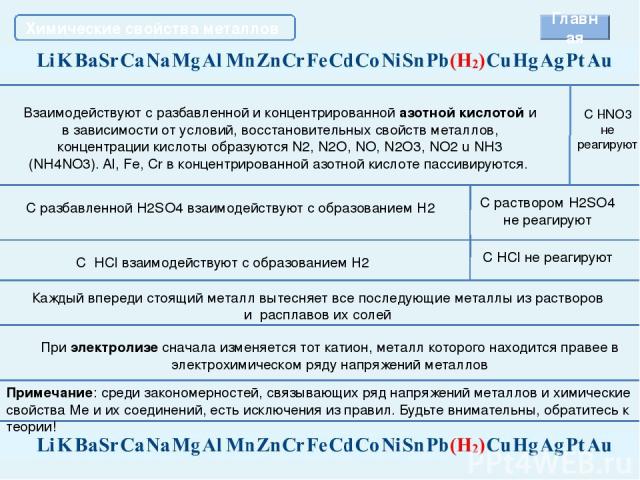
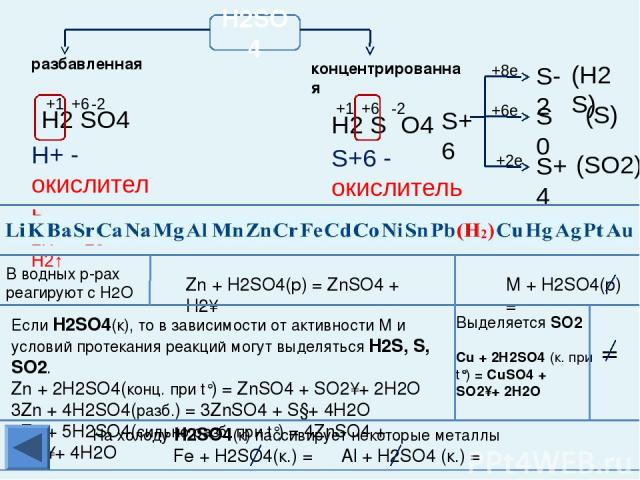
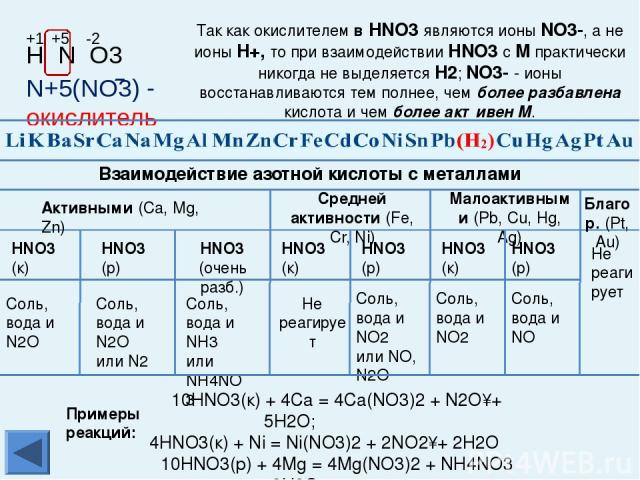
Химические свойства металлов Взаимодействуют с разбавленной и концентрированной азотной кислотой и в зависимости от условий, восстановительных свойств металлов, концентрации кислоты образуются N2, N2O, NO, N2O3, NO2 u NH3 (NH4NO3). Al, Fe, Cr в концентрированной азотной кислоте пассивируются. С HNO3 не реагируют Каждый впереди стоящий металл вытесняет все последующие металлы из растворов и расплавов их солей При электролизе сначала изменяется тот катион, металл которого находится правее в электрохимическом ряду напряжений металлов С разбавленной H2SO4 взаимодействуют с образованием Н2 С раствором H2SO4 не реагируют С HCl взаимодействуют с образованием Н2 C HCl не реагируют Примечание: среди закономерностей, связывающих ряд напряжений металлов и химические свойства Ме и их соединений, есть исключения из правил. Будьте внимательны, обратитесь к теории! Главная

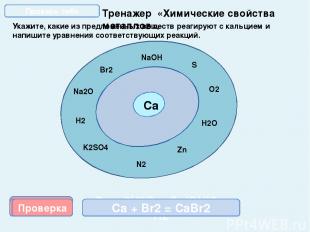
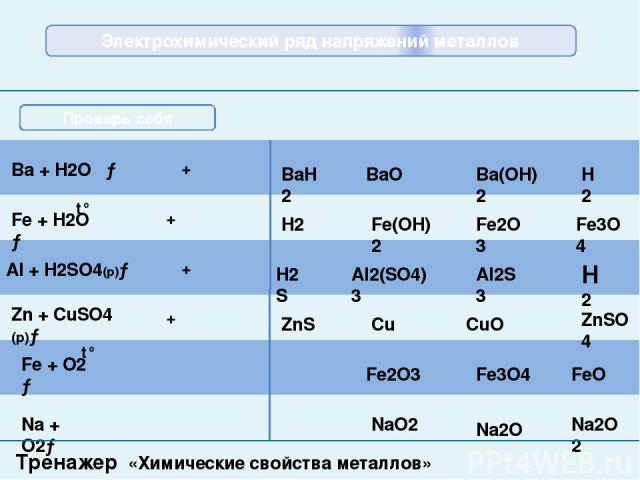
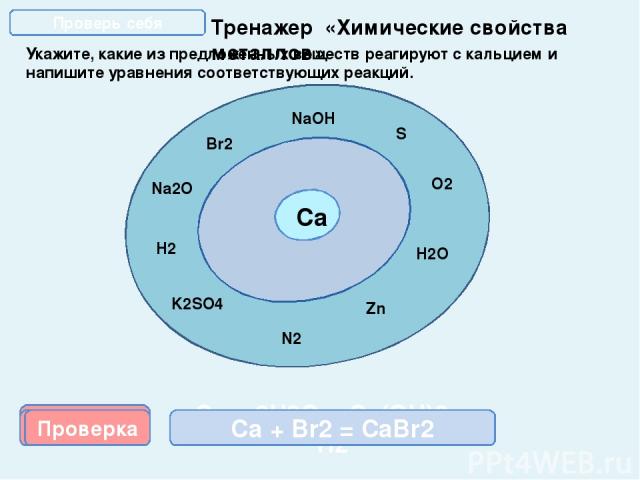
Тренажер «Химические свойства металлов» Укажите, какие из предложенных веществ реагируют с кальцием и напишите уравнения соответствующих реакций. Са NaOH O2 N2 H2O Zn K2SO4 S H2 Na2O Br2 Проверка Ca + S = CaS 2Са + О2 = 2СаО Проверка Проверка Проверка Проверка Проверка Са + 2Н2О = Са(ОН)2 + Н2 3Са + N2 = Ca3N2 Са + Н2 = CaН2 Са + Br2 = CaBr2 Проверь себя

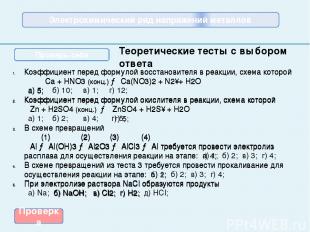
Коэффициент перед формулой восстановителя в реакции, схема которой Ca + HNO3 (конц.) → Ca(NO3)2 + N2↑+ H2O а) 5; б) 10; в) 1; г) 12; Коэффициент перед формулой окислителя в реакции, схема которой Zn + H2SO4 (конц.) → ZnSO4 + H2S↑ + H2O а) 1; б) 2; в) 4; г) 5; В схеме превращений (1) (2) (3) (4) Al → Al(OH)3 → Al2O3 → AlCl3 → Al требуется провести электролиз расплава для осуществления реакции на этапе: а) 1; б) 2; в) 3; г) 4; В схеме превращений из теста 3 требуется провести прокаливание для осуществления реакции на этапе: а) 1; б) 2; в) 3; г) 4; При электролизе раствора NaCl образуются продукты а) Na; б) NaOH; в) Cl2; г) H2; д) HCl; Теоретические тесты с выбором ответа Проверка Электрохимический ряд напряжений металлов Проверь себя Коэффициент перед формулой восстановителя в реакции, схема которой Ca + HNO3 (конц.) → Ca(NO3)2 + N2↑+ H2O а) 5; Коэффициент перед формулой окислителя в реакции, схема которой Zn + H2SO4 (конц.) → ZnSO4 + H2S↑ + H2O г) 5; В схеме превращений (1) (2) (3) (4) Al → Al(OH)3 → Al2O3 → AlCl3 → Al требуется провести электролиз расплава для осуществления реакции на этапе: г) 4; В схеме превращений из теста 3 требуется провести прокаливание для осуществления реакции на этапе: б) 2; При электролизе раствора NaCl образуются продукты б) NaOH; в) Cl2; г) H2;

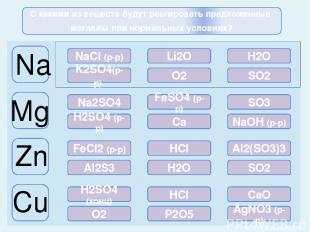
ошибка ошибка ошибка молодец молодец ошибка ошибка молодец молодец ошибка ошибка ошибка молодец ошибка молодец ошибка ошибка ошибка молодец ошибка ошибка ошибка ошибка молодец Na Mg Zn Cu NaCl (р-р) Li2O H2O K2SO4(р-р) O2 SO2 Na2SO4 FeSO4 (р-р) SO3 H2SO4 (р-р) Ca NaOH (р-р) FeCl2 (р-р) HCl Al2(SO3)3 Al2S3 H2O SO2 H2SO4 (конц) HCl CaO O2 P2O5 AgNO3 (р-р) С какими из веществ будут реагировать предложенные металлы при нормальных условиях?
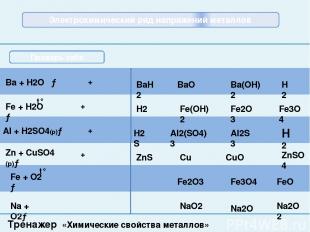
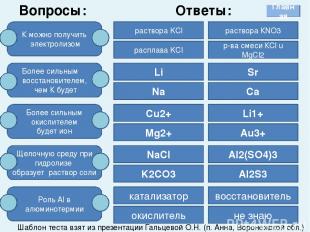
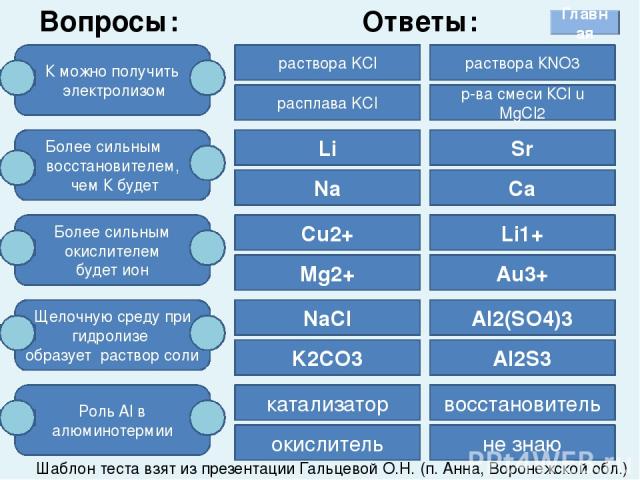
Вопросы: К можно получить электролизом Более сильным восстановителем, чем К будет Более сильным окислителем будет ион Щелочную среду при гидролизе образует раствор соли Роль Al в алюминотермии раствора KCl расплава KCl раствора КNO3 р-ва смеси КCl u MgCl2 Li Sr Ca Na Cu2+ Mg2+ Li1+ Au3+ NaCl K2CO3 Al2(SO4)3 Al2S3 катализатор окислитель восстановитель не знаю Ответы: Шаблон теста взят из презентации Гальцевой О.Н. (п. Анна, Воронежской обл.) Главная При выполнении этого задания необходимо выбрать правильный ответ и щелкнуть по нему левой кнопкой мыши.