Презентация на тему: Марганец и его соединения

Марганец и его соединения Обобщающее занятие 11 класс , химико-биологический

История открытия 1774 г. шведский химик К. Шееле Ю. Ганн «манганум» (от немецкого Manganerz — марганцевая руда).

Шееле Карл Вильгельм Карл Вильгельм Шееле (швед. Carl Wilhelm Scheele; 9 декабря 1742, Штральзунд, — 21 мая 1786, Чёпинг) — шведский химик, c 1775 года — член Королевской шведской академии наук. По образованию и профессии — фармацевт. Работал в аптеках различных городов Швеции, где и проводил химические исследования (с 1757 года). Шееле открыл многие неорганические и органические вещества. В 1774 году показал, что пиролюзит (природная двуокись марганца), считавшийся разновидностью магнитного железняка, — соединение неизвестного металла.

Нахождение в природе пиролюзит MnO2 (содержит 63,2 % марганца) манганит MnO2·Mn(OH)2 (62,5 % марганца) браунит Mn2O3 (69,5 % марганца) родохрозит MnCo3 (47,8 % марганца) псиломелан mMnO·MnO2·nH2O (45-60% марганца)

Пиролюзит Диоксид марганца (MnO2). Непрозрачный, цвет черный или серо-стальной. Пиролюзит обладает полупроводниковыми и пьезоэлектрическими свойствами. В соляной кислоте растворяется с выделением хлора. Молотый натуральный и синтетический пиролюзит (т. н. электролитический диоксид марганца, "ЭДМ") применяют в производстве гальванических элементов и батарей, для получения катализаторов типа гопкалита в специальных противогазах для защиты от СО. Из пиролюзита получают перманганат калия и соли марганца. В стекольном производстве пиролюзит применяют для обесцвечивания зеленых стекол, в лакокрасочном — для изготовления олифы и масла, в кожевенной — для выделки хромовых кож.

Манганит Хим.формула MnO·Mn(OH)2. Важная марганцевая руда. Кристаллы столбчатые, грубоисштрихованные. Примеси SiO2, Fe2O3 и др. Встречается в жилах с баритом, кальцитом, сидеритом, пиролюзитом.

Браунит Минерал назван в честь Вильгельма фон Брауна (1790 — 1872). Хим.формула Mn2O3·nSiO3. Тёмно-серый, коричнево серый. Непрозрачный. Используют в металлургической и химической промышленности, а также для производства марганца.

Родохрозит Родохрози т (от др.-греч. ῥόδον — роза и χρῶσις — окраска), Марганцевый шпат, малиновый шпат — рудообразующий минерал MnCO3. Цвет розовый, красный, желтовато-серый, коричневый. Полупрозрачный. Инки считали, что родохрозит — это кровь древних правителей, превратившихся в камень, поэтому минерал часто известен и как роза инков.Встречается в высокотемпературных месторождениях с родонитом, гранатом, брайнитом, тефроитом. В осадочных марганцевых месторождениях ассоциирует с марказитом, кальцитом, опалом и др. Имеет промышленную ценность: является сырьем для выплавки ферромарганца, для подшихтовки при выплавке чугуна и стали. Иногда используется в качестве декоративного камня, в ювелирном деле. Ограниченное использование вызвано совершенной спайностью минерала, из-за этого он практически не поддаётся обработке.
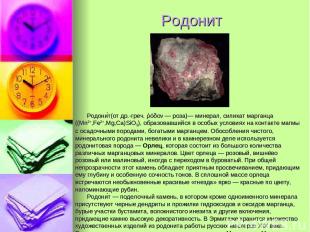
Родонит Родони т(от др.-греч. ῥόδον — роза)— минерал, силикат марганца ((Mn2+,Fe2+,Mg,Ca)SiO3), образовавшийся в особых условиях на контакте магмы с осадочными породами, богатыми марганцем. Обособления чистого, минерального родонита невелики и в камнерезном деле используется родонитовая порода — Орлец, которая состоит из большого количества различных марганцовых минералов. Цвет орлеца — розовый, вишнёво розовый или малиновый, иногда с переходом в буроватый. При общей непрозрачности этот камень обладает приятным просвечиванием, придающим ему глубину и особенную сочность тонов. В сплошной массе орлеца встречаются необыкновенные красивые «гнезда» ярко — красные по цвету, напоминающие рубин. Родони т — поделочный камень, в котором кроме одноименного минерала присутствуют черные дендриты и прожилки гидроксидов и оксидов марганца, бурые участки бустамита, волокнистого инезита и другие включения, придающие камню высокую декоративность. В Эрмитаже хранится множество художественных изделий из родонита работы русских мастеров XIX века. Родонит использовался при отделке колонн станции Маяковская Московского метро.

Получение Обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец Чистый марганец получают электролизом водных растворов сульфата марганца MnSO4

Задание группе -теоретиков. После занятий в классе на рабочем столе был найден листок с написанными уравнениями химических реакций. Середину листа закрывало большое коричневое пятно. Попробуйте восстановить уравнения. 2 KMnO4 + 5 SO4 = 6K2SO4 +2MnSO4 + 3H2O 10Fe 2SO4 + 5Fe2(SO4)3 + 2MnSO4 + 8H2O 3H2 2SO4 + 2 MnSO4 + 5O2↑ + 8H2O 5H = K2SO4 +2MnSO4 + 10CO2↑ +8H2O 2KMnO4 = 5 MnO2↓ + K2SO4 +2H2SO4

Задание группе –экспериментаторов Даны следующие вещества: KI H2SO4 KMnO4 NaOH FeSO4*7H2O H2O Напишите все возможные ОВР между указанными вначале веществами в молекулярной форме. Уравняйте их методом электронно-ионного баланса. Проделайте опыты с учетом Ваших теоретических рассуждений. Отметьте цвета исходных растворов веществ и продуктов реакции. Укажите на другие возможные особенности реакций (выделение газа, выпадение осадка и др) Обязательно отмечайте в тетради после каждой реакции соответствие Ваших теоретических рассуждений и практических результатов. Сделайте выводы по Вашим результатам.

Задание группе-промышленников. Написать все возможные способы получения марганца, включая электролиз солей (использование материала сообщения на занятии «Получение марганца»).
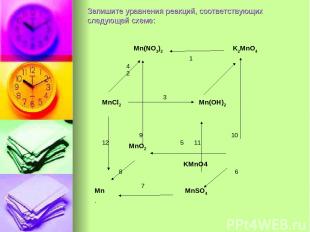
Запишите уравнения реакций, соответствующих следующей схеме: Mn(NO3)2 K2MnO4 1 4 2 3 MnCl2 Mn(OH)2 9 10 5 MnO2 KMnO4 12 11 8 6 7 Mn MnSO4 .