Презентация на тему: Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью

«Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью»

Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей - Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит. Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1 Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола) - Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».

Её величество Азотная кислота Яконюк Вера Сергеевна учитель химии МОУ Знаменская СОШ Урок химии 9класс

СОДЕРЖАНИЕ: Историческая справка Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические свойства.Специфические Таблица Применение

Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой: KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑ Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды Историческая справка
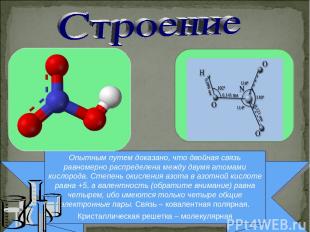
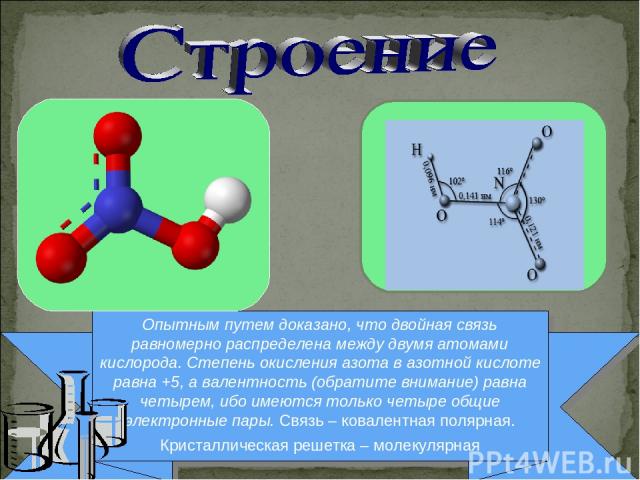
Опытным путем доказано, что двойная связь равномерно распределена между двумя атомами кислорода. Степень окисления азота в азотной кислоте равна +5, а валентность (обратите внимание) равна четырем, ибо имеются только четыре общие электронные пары. Связь – ковалентная полярная. Кристаллическая решетка – молекулярная
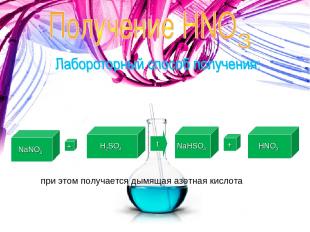
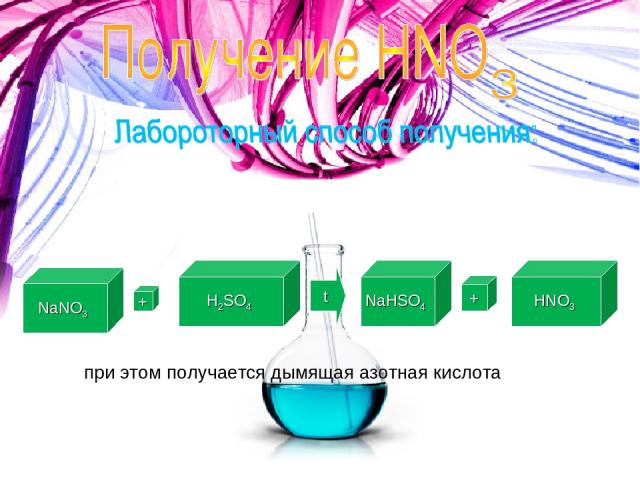
NaNO3 + H2SO4 t NaHSO4 + HNO3 при этом получается дымящая азотная кислота

1. Окисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO + 6H2O 3. Поглощения NO2 водой в присутствии кислорода: 4NO2 + 2H2O + O2= 4HNO3 Массовая доля HNO3 составляет около 60% 2. Окисления NO в NO2 на холоду под давлением (10 ат): 2NO + O2 = 2NO2

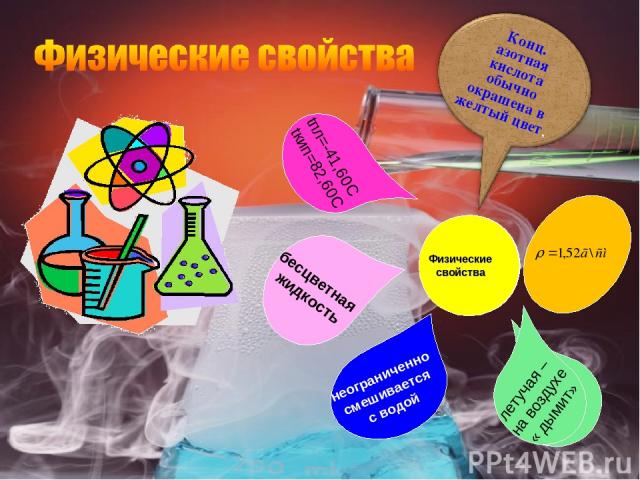
Физические свойства бесцветная жидкость tпл=-41,60C tкип=82,60C неограниченно смешивается с водой летучая – на воздухе « дымит»


Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + H2O CuO + 2H+ = Cu2+ + H2O Группа №2 CuCl2 + 2 NaOH = Cu(OH)2↓ + 2 NaCl (получение нерастворимого основания) Cu(OH)2 ↓+ 2 HNO3 = Cu(NO3)2 + 2 H2O - реакция ионного обмена, необратимая Cu(OH)2 ↓ + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + 2 H2O Cu(OH)2↓ + 2H+ = Cu2+ + 2 H2O Признак реакции – растворение голубого осадка Cu(OH)2 Группа №3 2 HNO3 + Na2CO3 = 2 NaNO3 + H2O + CO2 ↑ - реакция ионного обмена, необратимая 2 H+ + 2NO3- + 2 Na+ + CO3 2- = 2 Na+ +NO3- + H2O + CO2↑ 2 H+ + CO3 2- = H2O + CO2 ↑ Признак реакции – характерное «вскипание».


.

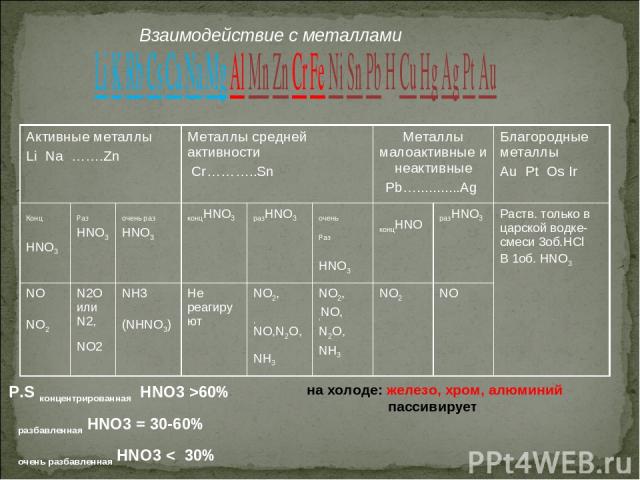
Взаимодействие азотной кислоты с металлами изучено довольно хорошо, т.к. конц. HNO3 используется в качестве окислителя ракетного топлива. Смысл заключается в том, что продукты реакции зависят от двух факторов: 1) концентрация азотной кислоты; 2) активность металла Комбинацией этих двух параметров и определяется состав продуктов реакции. Что может быть? а) металл может вступать в реакцию, а может не вступать (не реагировать вообще, пассивироваться); б) состав газов смешанный (как правило выделяется не один газообразный продукт, а смесь газов, иногда какой-то газ преобладает над другими); в) обычно водород в этих процессах не выделяется (есть исключение, когда на практике доказывается, что Mn + разб. HNO3 действительно выделяется газ водород) Главное правило: Чем активнее металл и чем разбавленнее азотная кислота, тем глубже идёт восстановление азотной кислоты (крайний вариант - восстановление до амммиака NH3, точнее до NH4NO3 ; здесь процесс воссстановления N{+5} + 8e ----> N{-3} ). Возможны промежуточные варианты восстановления до NO2, NO, N2O, N2 Общая схема процесса: HNO3 + Me ---> соль азотной кислоты (нитрат) + продукт восстановления азотной кислоты + H2O

Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий продукт по схеме: HNO3(р.)+Me(до H2)→нитрат+H2O+NH3(NH4NO3) HNO3(р.)+Me(после H2)→нитрат+H2O+NO HNO3(к.)+Me(до H2)→нитрат+H2O+N2O(N2) HNO3(к.)+Me(после H2)→нитрат+H2O+NO2 Концентрированная HNO3 на Al, Cr, Fe,Au, Pt не действует.
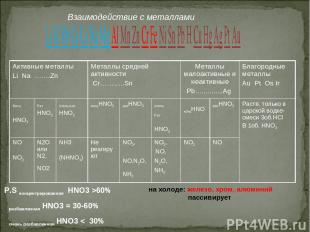
P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 < 30% на холоде: железо, хром, алюминий пассивирует Взаимодействие с металлами Активные металлы Li Na …….Zn Металлы средней активности Cr………..Sn Металлы малоактивные и неактивные Pb…...........Ag Благородные металлы Au Pt Os Ir Конц HNO3 Раз HNO3 очень раз HNO3 концHNO3 разHNO3 очень Раз HNO3 концHNO разHNO3 Раств. только в царской водке-смеси 3об.HCl B 1об. HNO3 NO NO2 N2O или N2, NO2 NH3 (NHNO3) Не реагируют NO2, ,NO,N2O,NH3 NO2, ,NO, N2O, NH3 NO2 NO

- производство азотных и комбинированных удобрений, -взрывчатых веществ (тринитротолуола и др.), -органических красителей. -как окислитель ракетного топлива. - В металлургии Азотная кислота применяют для травления и растворения металлов, а также для разделения золота и серебра.
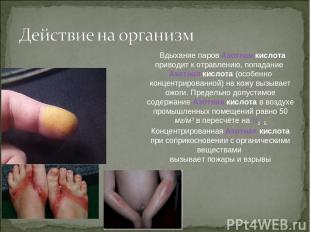
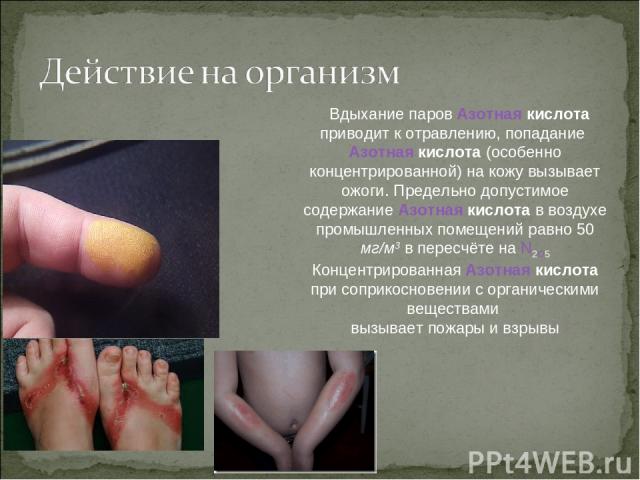
Вдыхание паров Азотная кислота приводит к отравлению, попадание Азотная кислота (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание Азотная кислота в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5 Концентрированная Азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы

Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3 а) краснеет б) желтеет в) остается бесцветной При взаимодействии с металлами азотная кислота является: а)окислителем, б)восстановителем, в)и тем, и другим. Азотная кислота в растворе не реагирует с веществом, формула которого: а) CO2 ; б) NaOH; в) Al(OH)3 ; г) NH3 . Царская водка- это а)концентрированный спирт б)3 объема HCl и 1 объем HNO3 в) концентрированная азотная кислота

1 - в 2 - б 3 - а 4 - а 5 - б

1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами, солями более слабых кислот обусловленные наличием в молекулах иона Н+; 2. Сильные окислительные свойства азотной кислоты обусловлены строением ее молекулы; При ее взаимодействии с металлами никогда не образуется водород, а образуются нитраты, оксиды азота или другие его соединения (азот, нитрат аммония) и вода в зависимости от концентрации кислоты и активности металла; 3. Сильные окислительные способности HNO3 широко применяются для получения различных важных продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)

§26 упр 4,5 Творческое задание –презентация история открытия азотной кислоты. Применение азотной кислоты

Спасибо за урок

О.С.Габриелян , И.Г. Остроумов Настольная книга учителя химии 9 класс. Дрофа 2003 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ Химия2000 http://ru.wikipedia.org/wiki/HNO3http://centralnyj.fis.ru/Petrochemicalshttp://dic.academic.ru/dic.nsf/bse/61981/%D0%90%D0%B7%D0%BE%D1