Презентация на тему: Свойства основных классов неорганических соединений
Основные классы неорганических соединений Обобщающий урок. 900igr.net

Урок-игра Девиз: «Все познается в сравнении».

Повторение основных понятий темы: ОКСИДЫ, КИСЛОТЫ, ОСНОВАНИЯ, СОЛИ.

Na2O MgO BaO Mn2O7 SiO2 тв CO2 H2O Чем особенен оксид водорода? газы Несолеобразующие Солеобразующие Основные оксиды Кислотные оксиды FeO CaO SO2 N2O3
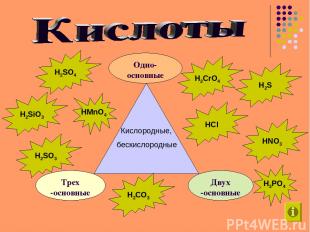
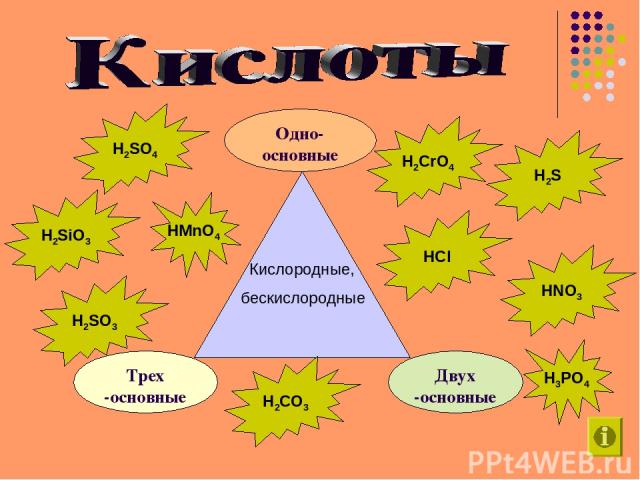
Кислородные, бескислородные HCl H2SO4 H2SO3 H2CO3 HNO3 H2S H3PO4 H2SiO3 H2CrO4 HMnO4
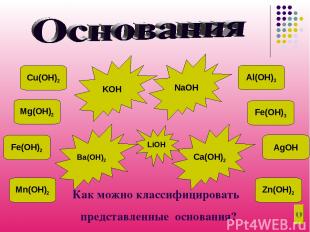
Как можно классифицировать представленные основания? Cu(OH)2 Al(OH)3 Fe(OH)3 Mg(OH)2 Ba(OH)2 Ca(OH)2 KOH NaOH LiOH AgOH Fe(OH)2 Mn(OH)2 Zn(OH)2

Разделите соли на растворимые и не растворимые. Дайте названия опираясь на признаки: средние, кислые, основные. У вас так получилось? Меn+ Аm - (анион кислотного остатка) NaCl Na2CO3 CuSO4 Al(NO3)3 NaHCO3 Mg(HSO4)2 (CuOH)2CO3 BaCl2 FeCl3 FeS Na3PO4 KNO3
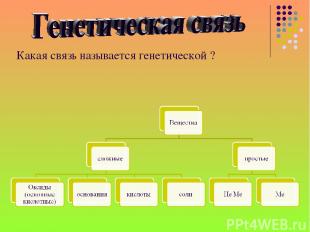
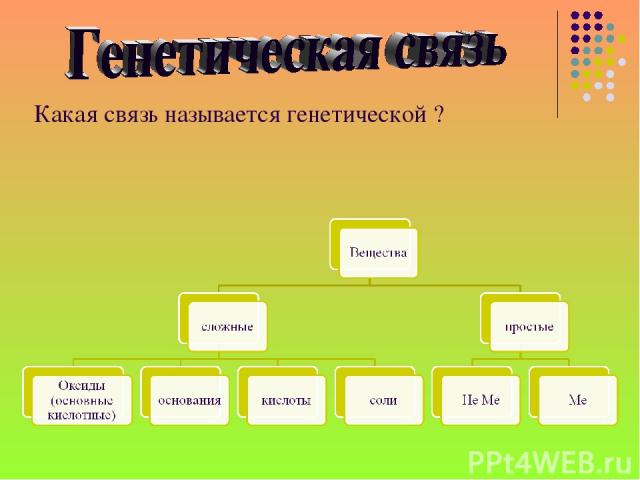
Какая связь называется генетической ?

Сколько генетических рядов можно выделить и какие они? Два генетических ряда: ряд Ме и не Ме.

Ряд не Ме: неметалл → кислотный оксид → кислота → соль. P → P2O5 → H3PO4 → Ca3(PO4)2 неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл. Si → SiO2 → Na2SiO3 → H2SiO2 → Si Ряд Ме: металл → основной оксид → основание (щелочь) → соль. Ca → CaO → Ca(OH)2 → Ca3(PO4)2 металл → основный оксид → соль → основание основный → оксид → металл. Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu

Проведение конкурсов 1. Нужно организовать 3 команды: Команда №1 – «Атом», №2 – «Молекула», №3 – «Ион». 2. Игра состоит из нескольких конкурсов с разными заданиями, которые оцениваются баллами. В конце урока, баллы будут подсчитаны и выставлены соответствующие оценки. 3. Капитан команды назначает своих участников по каждому конкурсу. 4. Если кто-либо в команде в течении всей игры не принимает в ней участие, то баллы снимаются со всей команды.

Конкурс № 1 «Теоретическая разминка.» Правила игры: 1. Каждая команда по очереди отвечает на вопросы представленные на слайде. Максимальная оценка за конкурс – 3 балла. (1 балл за каждый правильный ответ).

«Атом»: Сколько классов сложных веществ неорганической химии вам известно? Ответ. Четыре (оксиды, основания, кислоты, соли). «Молекула»: Сложные вещества, состоящие из двух элементов, один из которых кислород. Ответ. Оксиды. «Ион»: Сложные вещества, состоящие из атомов водорода и кислотных остатков. Ответ. Кислоты.

«Атом»: Сложные вещества, состоящие из атомов металла и одной или несколько гидроксильных групп. Ответ. Основания. «Молекула»: Сложные вещества, состоящие из атомов металла и кислотного остатка. Ответ. Соли. «Ион»: Назовите вещество, которое одновременно и оксид и гидрид. Ответ. Вода.

«Атом»: Соли, содержащие кислотный остаток азотной кислоты. Ответ. Нитраты. «Молекула»: Вещества, которые под действием щелочей и кислот меняют свой цвет. Ответ. Индикаторы. «Ион»: Соли, содержащие кислотный остаток сероводородной кислоты. Ответ. Сульфиды.

Конкурс № 2 «Найди родственников» Из дидактических карточек с формулами веществ. За 1 мин необходимо выбрать из предложенного перечня веществ: для команды «Атом» все - оксиды и соли, команды «Молекула» все - основания и соли, команды «Ион» все - кислоты и соли, записать их в таблицу. Дать им названия. Максимальная оценка за конкурс – 6 баллов. (0,5 баллов за каждый правильный ответ).

Конкурс № 3 «Третий лишний» За 1 мин необходимо найти на каждой строке лишнюю формулу вещества и объяснить, почему именно эта формула лишняя. Максимальная оценка за конкурс – 3 балла.

Задание команде «Атом»: Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ: 1. CO2 Fe(OH)3 SO3 2. AgNO3 NaOH Cu(OH)2 Задание команде «Молекула»: Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ: 1. HCl Al(OH)3 H2SO4 2. MgSO4 FeS K2O Задание команде «Ион»: Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ: 1. СuCl2 HNO3 H3PO4 2. Al2O3 H2S N2O5

Конкурс № 4 «Экспертиза» Каким способом можно распознать кислоты, не пробуя их на вкус? Какие индикаторы вы знаете? Что такое качественные реакции? Как действуют кислоты и щелочи на индикаторы?

Таблица изменения окраски индикаторов. Название индикатора Окраска индикатора в нейтральной среде Окраска индикатора в щелочной среде Окраска индикатора в кислой среде Лакмус Фиолетовая Синяя Красная Метиловый оранжевый Оранжевая Желтая Красно-розовая Фенолфталеин Бесцветная Малиновая бесцветная

Задание команде «Атом»: NaOH 2. HCl 3. NaCl Задание команде «Молекула»: 1.KBr 2.H2SO4 3.KOH Задание команде «Ион» : 1.HNO3 2.KI 3. LiOH За 1 минуту, используя индикатор, необходимо распознать, в какой пробирке находится каждое вещество, и объяснить почему. Записать уравнения диссоциации электролитов. Сравните свои выводы со слайдом. Максимальная оценка 6 баллов.

Уравнения диссоциации электролитов (вещества, которые в растворе и расплаве проводят электрический ток).

Растительные индикаторы. Растительный материал Нейтральная среда Кислая среда Щелочная среда Столовая свекла Розовая Ярко -розовая Желтая Вишня Розовая Ярко -розовая Желтая Серная смородина Розовая Ярко -розовая Желтая

Конкурс № 5 «Восстанови запись» За 3 мин необходимо: дописать пропущенные вещества, расставить коэффициенты и указать тип реакции. Затем команды обмениваются выполненными заданиями и проверяют их в течение 1 минуты. Каждое правильно записанное уравнение реакции оценивается в 1 балл (максимальная оценка 3 балла).

Решение задания конкурса «Восстанови запись» Задание команде «Атом». СuO + 2 HCl = CuCl2 + H2O (тип реакции обмена) Mg + Cl2 = Mg Cl2 (тип реакции соединения) 2Fe(OH)3 = 3H2O + Fe2O3 (тип реакции разложения) Задание команде «Молекула». Ca + Br2 = Ca Br2 (тип реакции соединения) Cu(OH)2 = H2O +CuO (тип реакции разложения) Zn + H2SO4 = ZnSO4 + H2 (тип реакции замещения) Задание команде «Ион». Na2O + 2HCl = 2NaCl +H2O (тип реакции обмена) 2Al(OH)3 = Al2O3+ 3H2O (тип реакции разложения) Mg + H2SO4= MgSO4+ H2 (тип реакции замещения)

Конкурс № 6 «Блиц». Каждая по очереди команда дает ответ на задаваемый вопрос. Вопросы будут представлены на слайде. Каждый правильный ответ оценивается в 1 балл (максимальная оценка 3 балла).

Задание команде «Атом». Сектор «Кислоты». Какая кислота содержится в желудочном соке человека: 1) Серная 2) Соляная 3) Фосфорная. Какая кислота используется в аккумуляторах: 1)Серная 2) Соляная 3) Фосфорная Какая кислота содержится в составе газированного напитка «Пепси-кола»: 1) Серная 2) Соляная 3) Фосфорная

Задание команде «Молекула». Сектор «Основания». 1.Какая щелочь используется для побелки стволов деревьев с малой концентрацией: 1)Гидроксид калия 2) гидроксид кальция 3) гидроксид натрия Какая щелочь называется каустической содой и применяется для производства искусственного волокна, а также для очистки продуктов нефтепереработки. 1)Гидроксид калия 2) гидроксид кальция 3) гидроксид натрия Какая щелочь более опасна: 1)Гидроксид калия 2) гидроксид кальция 3) гидроксид натрия

Задание команде «Ион». Сектор «Соли». 0,9 % раствор какой соли называют физраствором и применяют при потере крови: 1)хлорид натрия 2) нитрат серебра 3) хлорид кальция. 5% раствор какой соли применяют при аллергической реакции детям: 1)хлорид натрия 2) нитрат серебра 3) хлорид кальция. Какая соль применяется под названием «ляпис» и применяется в медицине для прижигания бородавок: 1)хлорид натрия 2) нитрат серебра 3) хлорид кальция.

Конкурс № 7 «Запиши уравнения». Запишите уравнения химических реакций по схеме: 1 команда : Оксид ртути(+2) = ртуть + кислород Алюминий + соляная кислота = хлорид алюминия + водород 2 команда: Цинк + кислород = оксид цинка Карбонат кальция = оксид кальция + оксид углерода ( +4) 3 команда: Оксид железа + алюминий = железо + оксид алюминия Сульфат цинка + гидроксид натрия = сульфат натрия + гидроксид цинка За правильное выполнение задания 4 балла.

Проверь себя. 1 команда 1) 2HgO =2 Hg + O2 2) 2Al + 6HCl =2 AlCl3 +3H2 2 команда 2Zn + O2 = 2ZnO CaCO3 = CaO + CO2 3 команда 1) Fe2O3 + 2Al = Al2O3 +2 Fe 2)FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4


H2 SO4 + ВаCl2 = Ва SO4 + 2H Cl SO4 2- + Ва2+ = Ва SO4