Презентация на тему: Свойства комплексных соединений

Тема 10. Комплексные соединения Занятие 2. Свойства комплексных соединений Учебные вопросы: 1. Природа химической связи в комплексных соединениях. 2. Реакции комплексных соединений. Устойчивость комплексных соединений и константа нестойкости.

Цели занятия: 1. Рассмотреть природу химической связи в комплексных соединениях. 2. Изучить реакции комплексных соединений и факторы, влияющие на устойчивость. 3. Рассмотреть применение комплексных соединений в военно-химической практике. Основная литература: 2. Общая и неорганическая химия. Учебное пособие. СВИРХБЗ. Ч 3. 2003. C. 83-96. Дополнительная литература: Учебная программа по дисциплине «Общая и неорганическая химия». 2001. 19 с. 2. М.И. Сафарова. Общая и неорганическая химия в схемах и таблицах. Ч.1. Теоретические основы неорганической химии. Учебное пособие. Саратов. СВИРХБЗ. 2006. С. 80.

1. Природа химической связи в комплексных соединениях

Способы описания химической связи в комплексных соединениях 1. Метод валентных связей (МВС). 2. Теория кристаллического поля (ТКП). 3. Метод молекулярных орбиталей (ММО).

Положения метода валентных связей 1. В комплексе связь между комплексообразователем и лигандами координационная (ковалентная, донорно- акцепторная). Ионы внешней и внутренней сферы связаны ионной связью. Донор электронов - лиганд с неподеленными электронными парами. Акцептор электронов – комплексообразователь со свободными орбиталями. Степень перекрывания орбиталей - мера прочности связи. 2. В образовании связей участвуют гибридизованные орбитали комплексообразователя, что определяет гео-метрию комплекса. 3. Магнитные свойства определяются наличием неспаренных электронов.
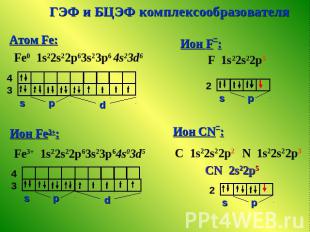
ГЭФ и БЦЭФ комплексообразователя

Спектрохимический ряд СO > CN– > NH3 > NO2– > H2O > OH > F > NО3> SCN Cl > Br > I Внешнесферный комплекс [FeF6]3– Внутрисферный комплекс [FeCN6]3–

Влияние поля лигандов на окраску комплексов

2. Реакции комплексных соединений. Устойчивость комплексных соединений и константа нестойкости

Диссоциация КС по внешней сфере (первичная диссоциация)

Диссоциация КС по внутренней сфере (вторичная диссоциация)

Реакции комплексных соединений по внешней сфере

Ступенчатое образование и диссоциация бромидных комплексов меди (II)

Реакции комплексных соединений с разрушением комплекса1.Образование более прочного комплексаFe3+ + 6 SCN- = [Fe(SCN)6]3- красная окраска[Fe(SCN)6]3- + 6 F- = 6 SCN- + [FeF6]3- отсутствие окраски[FeF6]3- + Al3+ = Fe3+ + [AlF6]3-; отсутствие окраски Fe3+ + 6 SCN- = [Fe(SCN)6]3- красная окраска
![2. Образование малорастворимого соединения [Ag(NH3)2]NO3 + KI = AgI + 2NH3 + KNO 2. Образование малорастворимого соединения [Ag(NH3)2]NO3 + KI = AgI + 2NH3 + KNO](/images/150/8094/310/img14.jpg)
2. Образование малорастворимого соединения [Ag(NH3)2]NO3 + KI = AgI + 2NH3 + KNO3 3. Разбавление K[AgCl2] = KCl + AgCl 4. Нагревание t0 K3[Cr(ОH)6] = 3KOH + Cr(OH)3 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6] + 3Сl2 + 4KOH = 2K2CrO4 + 6KCl + 8H2O

Сравнение прочности комплексов При одинаковом координационном числе Сравнение общих констант нестойкости При разном координационном числе Расчет средней константы нестойкости 2. Расчет концентрации комплексообразователя в растворе. 3. Сравнение ступенчатых констант нестойкости

При одинаковом координационном числе Сравнение прочности комплексов по общим константам нестойкости

При разном координационном числе 1. Сравнение устойчивости комплексов по средней константе нестойкости где n – координационное число

При разном координационном числе 2. Сравнение устойчивости комплексов по концентрации комплексообразователя Пример. Осуществима ли реакция [Ag(NH3)2]+ + Zn2+ + 2 NH3 [Zn(NH3)4]2+ + Ag+ ? Концентрации [Ag(NH3)2]+ и [Zn(NH3)4]2+ равны 0,1 моль/л.

При разном координационном числе 3. Сравнение устойчивости комплексов по ступенчатым константам нестойкости

Процессы образования и разрушения комплексов используются: - в аналитической химии; - при выделении химических элементов; - в гальванотехнике; - в борьбе с коррозией металлов; - в производстве ядерного горючего; - в практике дезактивации; - при индикации токсических соединений при производстве веществ с заранее заданными свойствами в качестве катализаторов и т.д.






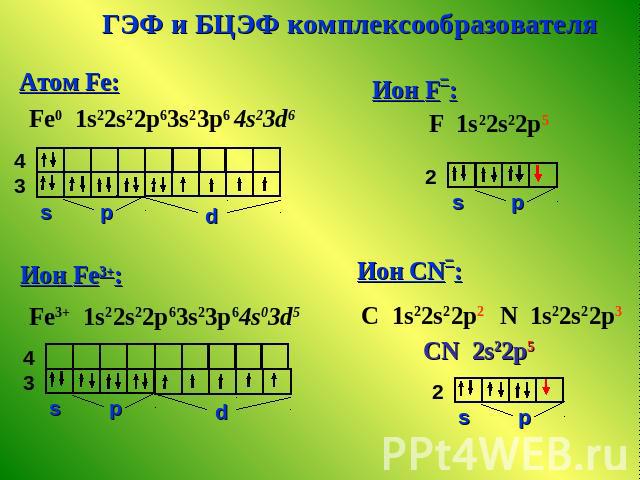
![Спектрохимический ряд СO > CN– > NH3 > NO2– > H2O > OH > F > NО3> SCN Cl > Br > I Внешнесферный комплекс [FeF6]3– Внутрисферный комплекс [FeCN6]3– Спектрохимический ряд СO > CN– > NH3 > NO2– > H2O > OH > F > NО3> SCN Cl > Br > I Внешнесферный комплекс [FeF6]3– Внутрисферный комплекс [FeCN6]3–](/images/150/8094/640/img6.jpg)






![Реакции комплексных соединений с разрушением комплекса1.Образование более прочного комплексаFe3+ + 6 SCN- = [Fe(SCN)6]3- красная окраска[Fe(SCN)6]3- + 6 F- = 6 SCN- + [FeF6]3- отсутствие окраски[FeF6]3- + Al3+ = Fe3+ + [AlF6]3-; отсутствие окраски F… Реакции комплексных соединений с разрушением комплекса1.Образование более прочного комплексаFe3+ + 6 SCN- = [Fe(SCN)6]3- красная окраска[Fe(SCN)6]3- + 6 F- = 6 SCN- + [FeF6]3- отсутствие окраски[FeF6]3- + Al3+ = Fe3+ + [AlF6]3-; отсутствие окраски F…](/images/150/8094/640/img13.jpg)
![2. Образование малорастворимого соединения [Ag(NH3)2]NO3 + KI = AgI + 2NH3 + KNO3 3. Разбавление K[AgCl2] = KCl + AgCl 4. Нагревание t0 K3[Cr(ОH)6] = 3KOH + Cr(OH)3 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6] + 3Сl2 + 4KOH = 2K2CrO4 + 6KC… 2. Образование малорастворимого соединения [Ag(NH3)2]NO3 + KI = AgI + 2NH3 + KNO3 3. Разбавление K[AgCl2] = KCl + AgCl 4. Нагревание t0 K3[Cr(ОH)6] = 3KOH + Cr(OH)3 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6] + 3Сl2 + 4KOH = 2K2CrO4 + 6KC…](/images/150/8094/640/img14.jpg)



![При разном координационном числе 2. Сравнение устойчивости комплексов по концентрации комплексообразователя Пример. Осуществима ли реакция [Ag(NH3)2]+ + Zn2+ + 2 NH3 [Zn(NH3)4]2+ + Ag+ ? Концентрации [Ag(NH3)2]+ и [Zn(NH3)4]2+ равны 0,1 моль/л. При разном координационном числе 2. Сравнение устойчивости комплексов по концентрации комплексообразователя Пример. Осуществима ли реакция [Ag(NH3)2]+ + Zn2+ + 2 NH3 [Zn(NH3)4]2+ + Ag+ ? Концентрации [Ag(NH3)2]+ и [Zn(NH3)4]2+ равны 0,1 моль/л.](/images/150/8094/640/img18.jpg)













