Презентация на тему: Классификация и свойства кислот

Тема урока:«Классификация и свойства кислот»

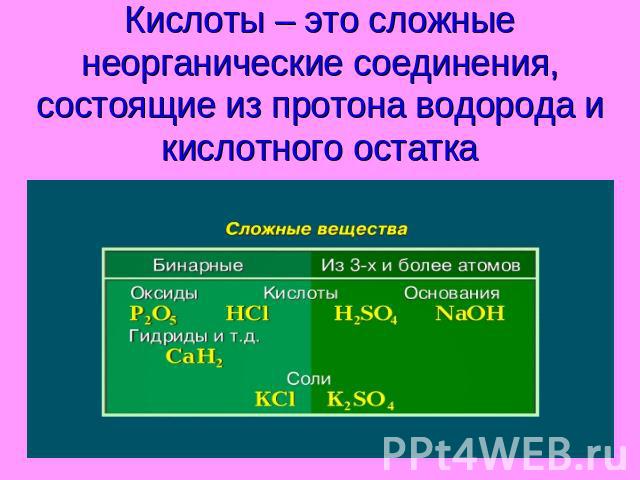
Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка

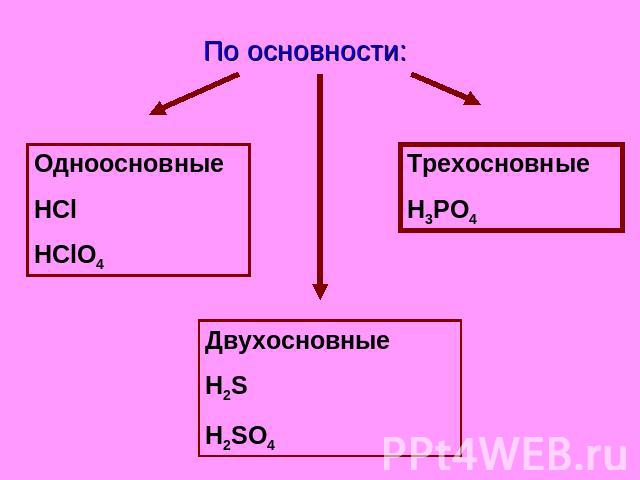
Классификация кислот. По основности:
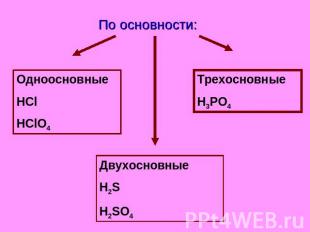
По основности: Одноосновные HCl HClO4 Трехосновные H3PO4 Двухосновные H2S H2SO4

По содержанию кислорода:

По содержанию кислорода: Кислородсодержащие HClO4 H2SO4 Бескислородные HCl H2S

По силе: Сила кислот уменьшается

По силе: Сила кислот уменьшается HClO4, H2SO4, HCl , H2SO3, H2СO3, H2S, H2SiO3 HNO3 H3PO4

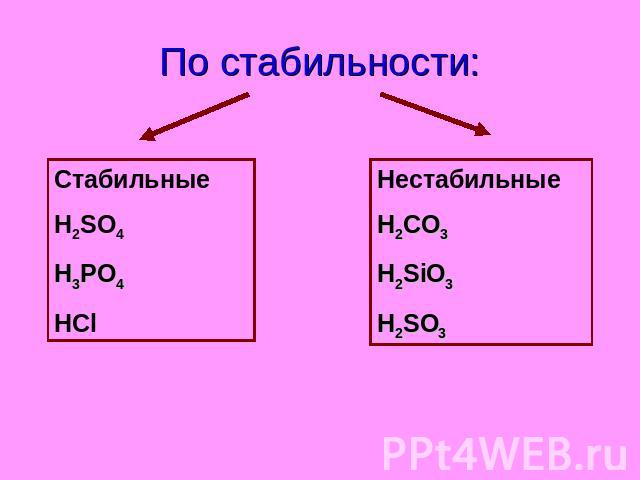
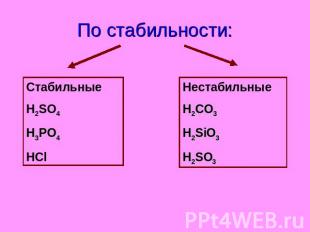
По стабильности: Стабильные H2SO4 H3PO4 HCl Нестабильные H2CO3 H2SiO3 H2SO3
По растворимости:

По растворимости:
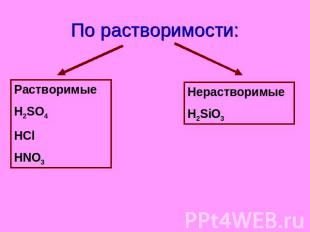
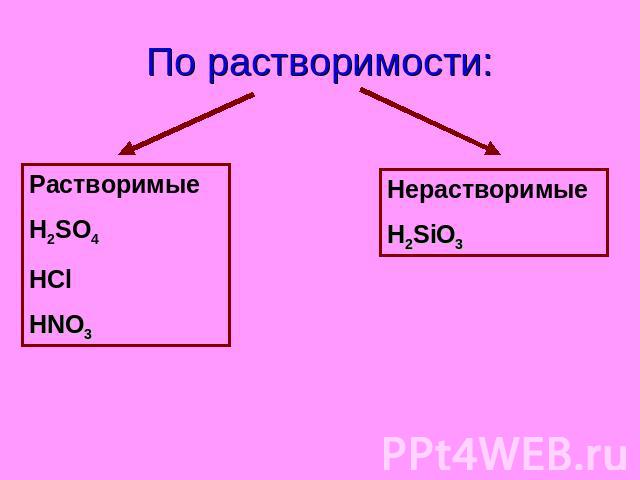
По растворимости: Растворимые H2SO4 HCl HNO3 Нерастворимые H2SiO3

Правила техники безопасности при работе с кислотами 1. При разбавлении кислот водой следует кислоту тонкой струйкой при перемешивании наливать в воду, а не наоборот. 2. Если случайно кислота попадет на руку или на одежду, то немедленно смойте ее большим количеством воды, а потом обработайте место раствором гидрокарбоната натрия (соды).
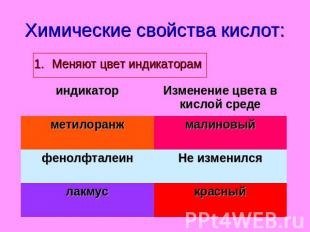
Химические свойства кислот: Меняют цвет индикаторам

2. Кислота + Металл→ соль + Н2 Три условия: кислота растворимая (кроме HNO3) Ме стоит в ряду активности до водорода Получается растворимая соль 1) Cu + НСl —> не идет 2) Zn + 2 HCl —> ZnCI2 + H2 ↑ 3) Na + H3PO4 —> 4) Ca + H2SO4 —>
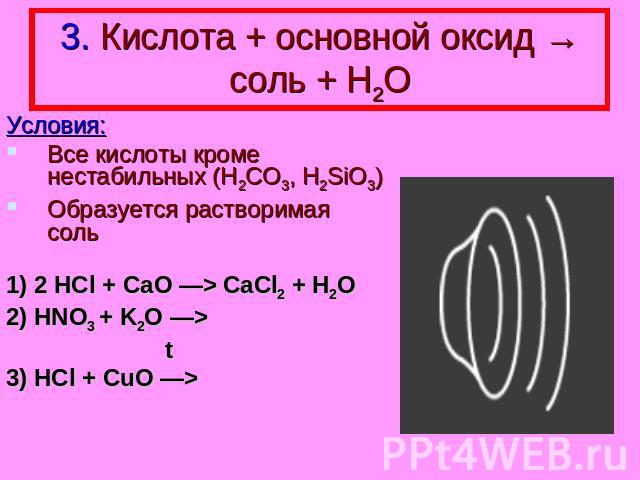
3. Кислота + основной оксид → соль + Н2О Условия: Все кислоты кроме нестабильных (H2CO3, H2SiO3) Образуется растворимая соль 1) 2 HCl + CaO —> CaCl2 + H2O 2) HNO3 + K2O —> t 3) HCl + CuO —>

4. Кислота + амфотерный оксид → соль + Н2О Условия: Все кислоты кроме нестабильных (H2CO3, H2SiO3) Образуется растворимая соль 1) 6 HCl + Al2O3 —> 2 AlCl3 + 3 H2O 2) HNO3 + ZnO —> 3) HCl + BeO —>

5. Кислота + основание → соль + Н2О (реакция нейтрализации) 1) H2SO4 + 2 KOH —> K2SO4 + 2 H2O 2) HCl + Al(OH)3 —> 3) HNO3 + Zn(OH)2 —>

6. Кислота + соль → соль* + кислота* Должно выполняться одно из двух условий: Один из продуктов реакции – летучее вещество (газ) Один из продуктов реакции выпадает в осадок 1) 2 HCl + CaCO3 —> CaCl2 + H2O + CO2↑ 2) H2SO4 + BaCl2 —> BaSO4↓ + 2 HCl 3) HCl + AgNO3 —>

5. Кислота + основание → соль + Н2О (реакция нейтрализации) 1) H2SO4 + 2 KOH —> K2SO4 + 2 H2O 2) HCl + Al(OH)3 —> 3) HNO3 + Zn(OH)2 —>

Способы получения кислот: 1. Кислотный оксид + Н2О → кислота SO3 + H2O → H2SO4 2. Водород + НеМе → кислота Н2 + Cl2 → 2 HCl 3. Кислота + соль → соль* + кислота* t 2 NaCl + H2SO4 → Na2SO4 + 2 HCl↑

Домашнее задание § 38 читать Урок учить Стр. 148 ?: 9,10,11