Презентация на тему: Классификация и свойства кислот

Презентация может использоваться на уроках химии в 8 классе при изучении новой темы 5klass.net

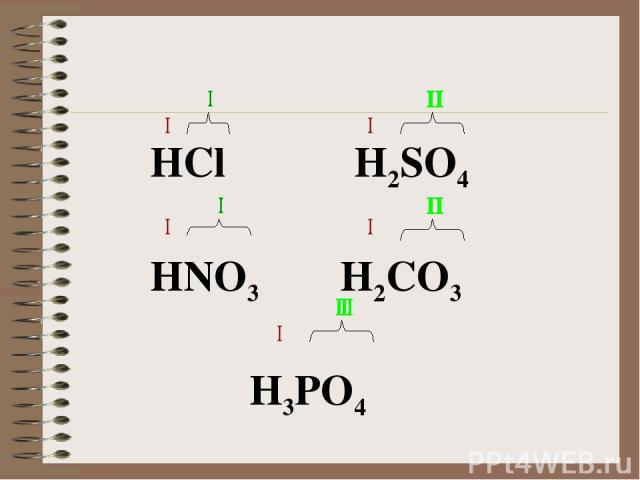
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на атомы металла, и кислотного остатка. Общая формула кислот: Hx(Ac), где Ас- кислотный остаток (от англ. аcid- кислота); x- число атомов водорода, равное валентности кислотного остатка.
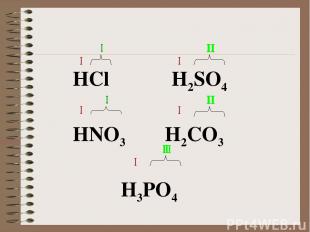
HCl H2SO4 HNO3 H2CO3 H3PO4

Кислоты вокруг нас а) Дождевая вода (Слабый раствор Н2СО3, НNO3; c дождями ежегодно выпадает на Землю ~100 млн тонн НNO3). б) Кислоты в нашей пище (Фрукты, овощи, молочные продукты, соусы, приправы, лекарства). в) Кислоты в природе (Муравьи, крапива, гусеницы, жуки- стреляют уксусной и серной кислотой; тысяченожки испускают пары синильной кислоты; мухоморы, лишайники, более 800 видов растений вырабатывают синильную кислоту).

г) Самая значительная функция кислот в природе- разрушение горных пород и создание почвы. д) Роль кислот в человеческом организме (Кислоты- витамины, соли фосфорной кислоты- строительный материал костей, зубов, ногтей; соляная кислота- в желудке выполняет пищеварительную и бактерицидную функции). Общее число существующих кислот велико, его трудно определить даже приблизительно. Наибольшее значение имеют 30-50 кислот (неорганических или минеральных).
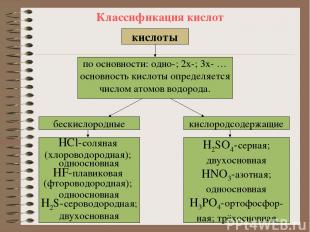
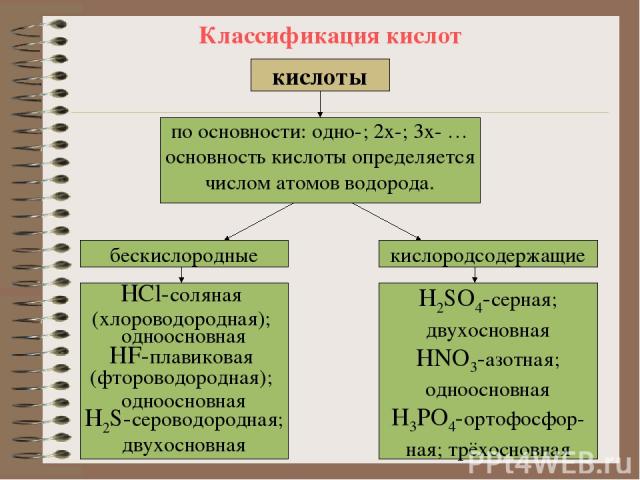
Классификация кислот кислоты кислоты по основности: одно-; 2х-; 3х- … основность кислоты определяется числом атомов водорода. бескислородные кислородсодержащие НCl-соляная (хлороводородная); одноосновная HF-плавиковая (фтороводородная); одноосновная H2S-сероводородная; двухосновная Н2SO4-cерная; двухосновная HNO3-азотная; одноосновная H3PO4-ортофосфор- ная; трёхосновная
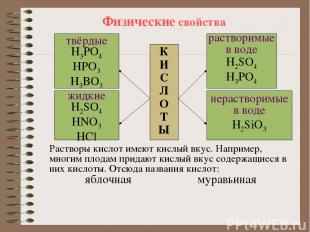
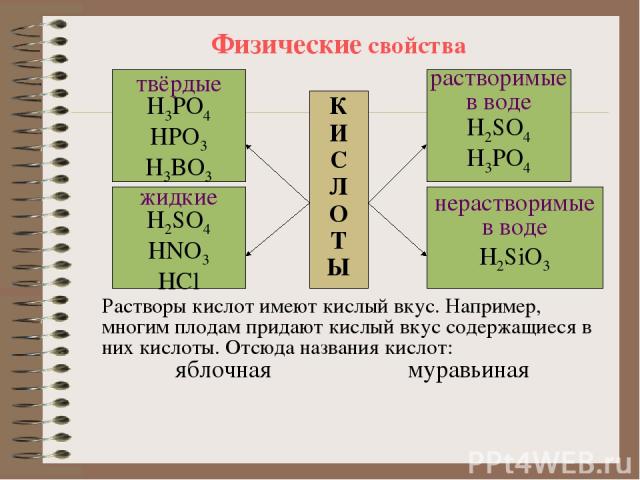
Физические свойства К И С Л О Т Ы твёрдые H3PO4 HPO3 H3BO3 жидкие H2SO4 HNO3 HCl растворимые в воде H2SO4 H3PO4 нерастворимые в воде H2SiO3 Растворы кислот имеют кислый вкус. Например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: яблочная муравьиная лимонная щавелевая
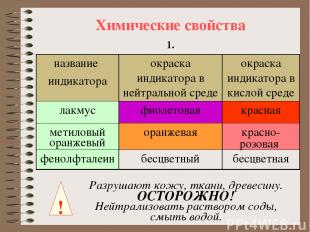
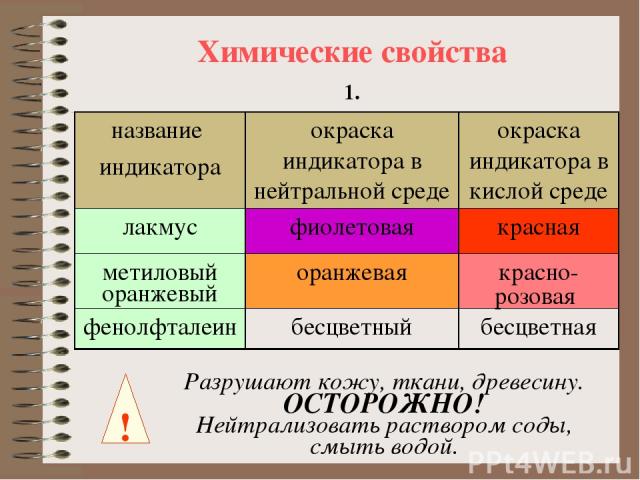
Химические свойства 1. ! Разрушают кожу, ткани, древесину. ОСТОРОЖНО! Нейтрализовать раствором соды, смыть водой. название индикатора окраска индикатора в нейтральной среде окраска индикатора в кислой среде лакмус фиолетовая красная метиловый оранжевый оранжевая красно-розовая фенолфталеин бесцветный бесцветная
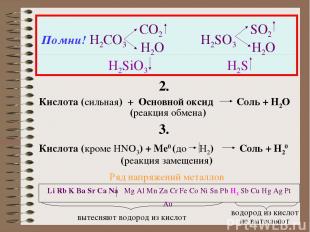
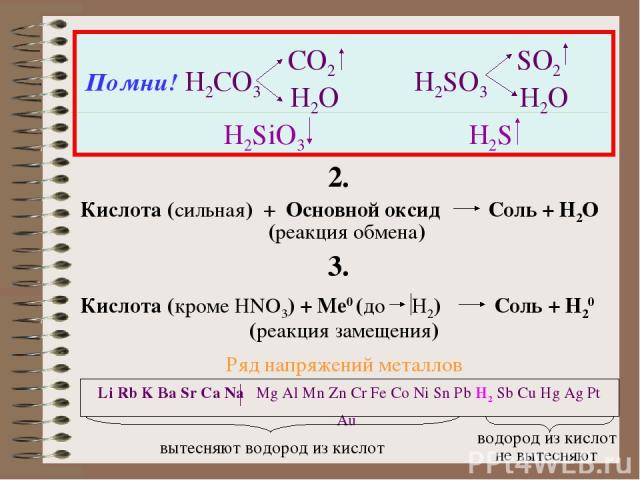
Помни! H2CO3 CO2 H2O H2SO3 SO2 H2O H2SiO3 H2S 2. Кислота (сильная) + Основной оксид Соль + H2O (реакция обмена) 3. Кислота (кроме HNO3) + Ме0 (до H2) Соль + Н20 (реакция замещения) Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au вытесняют водород из кислот водород из кислот не вытесняют Ряд напряжений металлов

Русский химик, академик Петербургской Академии наук. Основоположник физической химии. В 1863 г. составил вытеснительный ряд металлов, который называется по имени ученого.

3. Кислота (сильная) + Основание (любое) Соль + H2O ( реакция обмена ) Знаете ли вы ? Когда укусит муравей, то место укуса начинает болеть, так как на кожу попала сильная муравьиная кислота. Смажьте место укуса нашатырным спиртом и вы тотчас же избавитесь от боли, потому что нашатырный спирт – щелочь, уничтожает кислоту. Смазывание укушенного пчелой места нашатырным спиртом действует также успокаивающе.

4. Кислота (сильная) + Соль (слабых кислот) Соль + Кислота (слабая) , , ( Реакция обмена ) 5. Кислота + Соль Кислота* + Соль* В соответствии с рядом кислот (каждая предыдущая кислота может вытеснить из соли последующую): H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3 HNO3 H3PO4 Образуется другая соль и кислота. ( Реакция обмена ) Вывод: кислоты _ химически активные вещества.