Презентация на тему: Класс Алкены

задача Дано: W(С)=85,7% W(Н)=14,3% DН2(СХНY)=14 (СХНY)=? Ответ:С2Н4 900igr.net

Тема урока: Непредельные углеводороды Этилен Строение Получение Свойства Применение

Девиз урока: Все познается в сравнении

Цели и задачи урока Расширить знания об углеводородах, их классификации, дать понятие о этиленовых углеводородах. Узнать особенности строения алкенов, общую формулу алкенов, физические и химические свойства. Уметь записывать молекулярные, структурные, электронные формулы алкенов, уметь называть вещества по систематической номенклатуре. Уметь доказывать химические свойства алкенов, записывать уравнения реакций, сравнивать их со свойствами предельных углеводородов. Знать способы получения и области применения алкенов. Развить познавательную и творческую деятельность, умений сравнивать и обобщать, развивать аналитические способности мышления учащихся. Воспитать умственный труд, продолжить формирование диалектико-материалистического мировоззрения учащихся, воспитание бережного отношения к природе
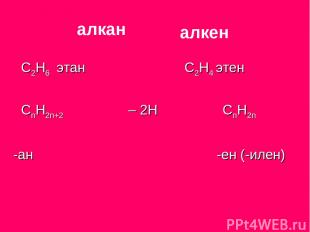
С2Н6 этан С2Н4 этен СnН2n+2 – 2H CnH2n -ан -ен (-илен) алкан алкен

Физические свойства С2-С4-Г С5-С18-Ж С19-Т

СОСТАВИТЬ ДЛЯ ПЕНТЕНА-2 ЧЕТЫРЕ ИЗОМЕРА (ПО ОДНОМУ НА КАЖДЫЙ ВИД)

Составить для пентена-2 четыре изомера(по одному на каждый вид) сн3-сн=сн-сн2-сн3 пентен-2 Структурная изомерия Изомерия углеродного скелета сн2=с-сн2-сн3 сн3 2-метил-бутен-1 Изомерия положения кратной связи сн2=сн-сн2-сн2-сн3 пентен-1

Межклассовая изомерия сн2 н2с сн2 циклопентан н2с сн2 Пространственная изомерия (геометрическая) н н н3с н с=с с=с н3с сн2-сн3 н сн2-сн3 цис-пентен-2 транс-пентен-2

Способы получения алкенов Промышленные(крекинг алканов,дегидрирование алканов, пиролиз нефти) Лабораторные(дегидрогалогенирование галогеналканов, дегалогенирование дигалогеналканов, дегидратация спиртов)


Получение алкенов 1.Дегидрогалогенирование галогеналканов СН3-СН-СН2-СH3+NaOH спирт. CH3-CH=CH-CH3+NaBr+H2O Br 2-бромбутан бутен-2 2.Дегидрирование алканов СН2=СН-СН2-СН3+Н2 С4Н10 бутен-1 СН3-СН=СН-СН3+Н2 бутан бутен-2 3.дегидратация спиртов СН3-СН2-ОН СН2=СН2+Н2О этанол этен 4.крекинг алканов С16Н34 С8Н18+С8Н16 гексадекан октан октен 5.Дегалогенирование дигалогеналканов СН3-СН-СН-СН3+Zn СН3-СН=СН-СН3+ZnBr2 Br Br 2,3-дибромбутан бутен-2 6.Пиролиз метана 2СН4 СН2=СН2+2Н2
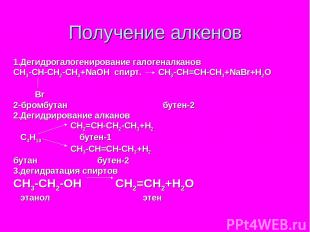
Получение алкенов 1.Дегидрогалогенирование галогеналканов СН3-СН-СН2-СH3+NaOH спирт. CH3-CH=CH-CH3+NaBr+H2O Br 2-бромбутан бутен-2 2.Дегидрирование алканов СН2=СН-СН2-СН3+Н2 С4Н10 бутен-1 СН3-СН=СН-СН3+Н2 бутан бутен-2 3.дегидратация спиртов СН3-СН2-ОН СН2=СН2+Н2О этанол этен

Крекинг алканов С16Н34 С8Н18+С8Н16 Дегалогенирование дигалогеналканов СН3-СН-СН-СН3+Zn СН3-СН=СН-СН3+ ZnВr2 Вr Вr Пиролиз метана 2СН4 СН2=СН2+2Н2

АЛКАНЫ АЛКЕНЫ СnН2n+2 SP³ 109º28‘ 0,154 НМ Тетраэдрическое -ан Структурная изомерия (Изомерия углеродного скелета) Cn Н 2n SP² 120º 0,134 НМ Плоское -ен Структурная изомерия (изомерия углеродного скелета, положение кратной связи, межклассовая изомерия). Пространственная изомерия (геометрическая)

Раз, два, три, четыре, Дышим глубже, машем шире…

Химические свойства алкенов Электрофильное присоединение (гидрирование, галогенирование, гидрогалогенирование, гидратация ) Полимеризация Окисление (горение, реакция Вагнера, каталитическое окисление)



Химические свойства алкенов Реакция присоединения 1.Галогенирование (кач. Реакция на = связь) СН2=СН2+Br 2 CН2Br-CН2Br Этен 1,2-дибромэтан 2.Гидрирование алкенов СН3-СН=СН2+Н2 СН3-СН2-СН3 пропен пропан
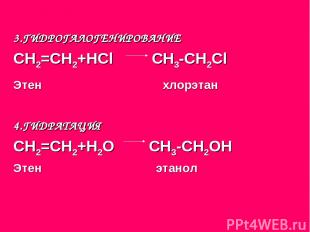
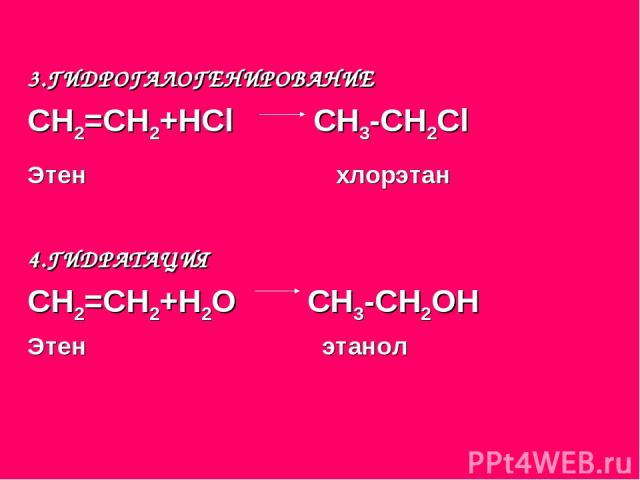
3.ГИДРОГАЛОГЕНИРОВАНИЕ СН2=СН2+НСl СН3-СН2Сl Этен хлорэтан 4.ГИДРАТАЦИЯ СН2=СН2+Н2О СН3-СН2ОН Этен этанол
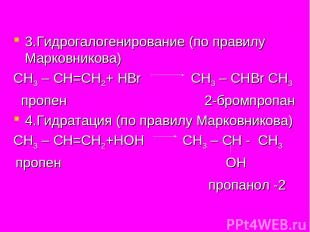
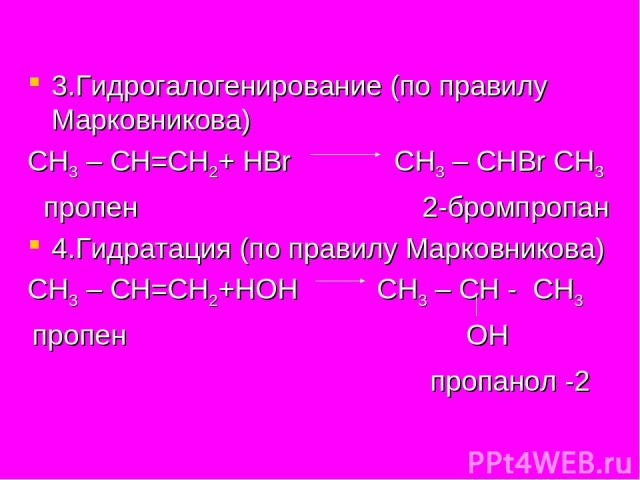
3.Гидрогалогенирование (по правилу Марковникова) СН3 – СН=СН2+ НBr СН3 – СНBr СН3 пропен 2-бромпропан 4.Гидратация (по правилу Марковникова) СН3 – СН=СН2+НОН СН3 – СН - СН3 пропен ОН пропанол -2

5.Полимеризация nCН2= CН2 (… - СН2 - СН2 - …)n мономер полимер Этилен Полиэтилен
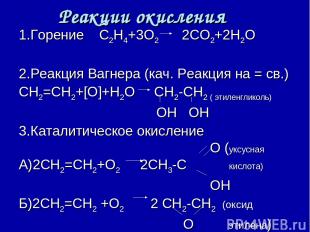
Реакции окисления 1.Горение С2Н4+3О2 2СО2+2Н2О 2.Реакция Вагнера (кач. Реакция на = св.) СН2=СН2+[О]+Н2О СН2-СН2 ( этиленгликоль) ОН ОН 3.Каталитическое окисление О (уксусная А)2СН2=СН2+О2 2СН3-С кислота) ОН Б)2СН2=СН2 +О2 2 СН2-СН2 (оксид О этилена)

Качественные реакции на алкены С бромной водой( галогенирование) СН2=СН2+Вr2 СН2Br - СН2Br этен 1,2-дибромэтан Реакция Вагнера (окисление) СН2=СН2+ [О] + Н2О СН2 - СН2 этен ОН ОН этиленгликоль

Состав строение свойства применение Причинно-следственная связь

АЛКАНЫ АЛКЕНЫ СnН2n+2 SP³ 109º28‘ 0,154 НМ Тетраэдрическое -ан Структурная изомерия (Изомерия углеродного скелета) Реакции окисления (горения) Реакции замещения Реакции дегидрирования Cn Н 2n SP² 120º 0,134 НМ Плоское -ен Структурная изомерия (изомерия углеродного скелета, положение кратной связи, межклассовая изомерия). Пространственная изомерия (геометрическая) Реакции окисления (горения, каталитическое окисление, реакция Вагнера) Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация) Реакции полимеризации Реакции дегидрирования

Применение этилена Этанол (бутадиен-1,3; уксусная кислота) Дихлорэтан (хлорвинил,эиленгликоль) Стирол (полистирол) Оксид этилена (полиэтилен)

Применение пропилена Полипропилен Ацетон Глицерин Полиакрилонитрил Кумол(фенол)

C2H5CI C2H4 C2H6 ? C3H8 C2H4CI2 Закрепление Осуществите превращения:

С2Н4+НСl С2Н5Сl (гидрогалогенирование) хлорэтан С2Н4+Н2 С2Н6 (гидрирование) этан С2Н4+Сl2 С2Н4Сl2 1,2- дихлорэтан С2Н6 + CI2 С2Н5CI+НCI хлорэтан C2Н5СI+СН3CI+2Na С3Н8+NaCI (р. Вюрца) пропан

Домашнее задание Глава 4, §1 упр.1,3,4,5,9,10,14 Задача 1






















![Реакции окисления 1.Горение С2Н4+3О2 2СО2+2Н2О 2.Реакция Вагнера (кач. Реакция на = св.) СН2=СН2+[О]+Н2О СН2-СН2 ( этиленгликоль) ОН ОН 3.Каталитическое окисление О (уксусная А)2СН2=СН2+О2 2СН3-С кислота) ОН Б)2СН2=СН2 +О2 2 СН2-СН2 (оксид О этилена) Реакции окисления 1.Горение С2Н4+3О2 2СО2+2Н2О 2.Реакция Вагнера (кач. Реакция на = св.) СН2=СН2+[О]+Н2О СН2-СН2 ( этиленгликоль) ОН ОН 3.Каталитическое окисление О (уксусная А)2СН2=СН2+О2 2СН3-С кислота) ОН Б)2СН2=СН2 +О2 2 СН2-СН2 (оксид О этилена)](https://fs3.ppt4web.ru/images/132073/183579/640/img23.jpg)
![Качественные реакции на алкены С бромной водой( галогенирование) СН2=СН2+Вr2 СН2Br - СН2Br этен 1,2-дибромэтан Реакция Вагнера (окисление) СН2=СН2+ [О] + Н2О СН2 - СН2 этен ОН ОН этиленгликоль Качественные реакции на алкены С бромной водой( галогенирование) СН2=СН2+Вr2 СН2Br - СН2Br этен 1,2-дибромэтан Реакция Вагнера (окисление) СН2=СН2+ [О] + Н2О СН2 - СН2 этен ОН ОН этиленгликоль](https://fs3.ppt4web.ru/images/132073/183579/640/img24.jpg)


















