Презентация на тему: Кислород

Кислород Кислород (От латинского Oхygenium), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева расположен во втором периоде в группе VI. 900igr.net

Природный кислород состоит из … Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2 s 2 р 4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2-при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления -2 и, реже, -1. По шкале Полинга, электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора ). В свободном виде кислород — газ без цвета, запаха и вкуса.

Общая характеристика. Кислород – самый распространённый химический элемент в земной коре. Воздух содержит 0,209 объёмных долей, или 20,9% кислорода, что составляет примерно 1/5 по объёму. Кислород входит в состав почти всех окружающих нас веществ ( вода, минералы, песок… )

История открытия История открытия кислорода, как и азота, связана с продолжавшимся несколько веков изучением атмосферного воздуха. О том, что воздух по своей природе не однороден, а включает части, одна из которых поддерживает горение и дыхание, а другая — нет, знали еще в 8 веке китайский алхимик Мао Хоа, а позднее в Европе — Леонардо да Винчи. В 1665 английский естествоиспытатель Р. Гук писал, что воздух состоит из газа, содержащегося в селитре, а также из неактивного газа, составляющего большую часть воздуха. История открытия кислорода, как и азота, связана с продолжавшимся несколько веков изучением атмосферного воздуха. О том, что воздух по своей природе не однороден, а включает части, одна из которых поддерживает горение и дыхание, а другая — нет, знали еще в 8 веке китайский алхимик Мао Хоа, а позднее в Европе — Леонардо да Винчи. В 1665 английский естествоиспытатель Р. Гук писал, что воздух состоит из газа, содержащегося в селитре, а также из неактивного газа, составляющего большую часть воздуха.

Нахождение в природе Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8% (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объему). Элемент кислород входит в состав более 1500 соединений земной коры

Первые получения О2 Шведский аптекарь и химик Карл Шееле начал изучать состав воздуха в 1768. В течение трех лет он разлагал нагреванием селитры (KNO3, NaNO3) и другие вещества и получал «огненный воздух», поддерживающий дыхание и горение. Но результаты своих опытов Шееле обнародовал только в 1777 году в книге «Химический трактат о воздухе и огне». В 1774 английский священник и натуралист Дж. Пристли нагреванием «жженой ртути» (оксида ртути HgO) получил газ, поддерживающий горение. Будучи в Париже, Пристли, не знавший, что полученный им газ входит в состав воздуха, сообщил о своем открытии А. Лавуазье и другим ученым.

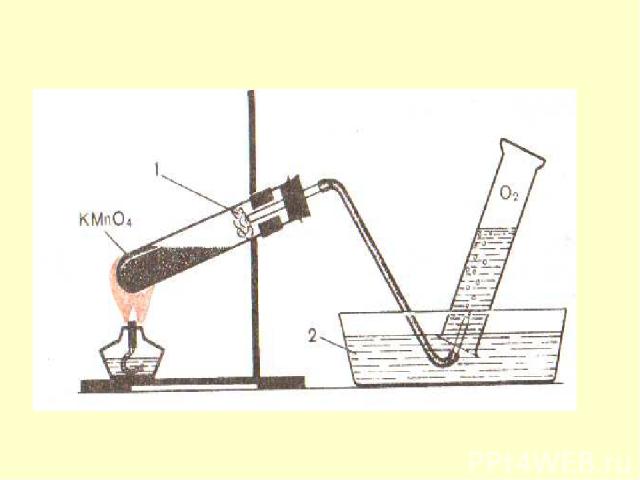
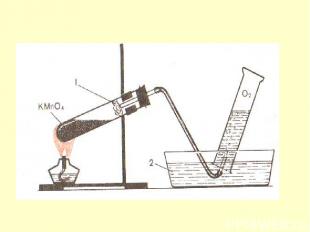
Получение В лаборатории небольшие количества не очень чистого кислорода можно получить при нагревании перманганата калия KMnO4 : 2KMnO4 = K2MnO4 + MnO2 + O2. Более чистый кислород получают разложением пероксида водорода H2O2 в присутствии каталитических количеств твердого диоксида марганца MnO2 : 2Н2О2 = 2Н2О + О2. Кислород образуется при сильном (выше 600°C) прокаливании нитрата натрия NaNO3 : 2NaNO3 =2NaNO2 + О2, При нагревании некоторых высших оксидов Тоже можно получитьО2 : 4CrO3= 2Cr2O3 + 3О2; 2PbO2 = 2PbO + О2; 3MnO2 = Mn3O4 + О2.

Кто придумал такое название? В 1775 Лавуазье пришел к выводу, что обычный воздух состоит из двух газов — газа, необходимого для дыхания и поддерживающего горение, и газа «противоположного характера» — азота. Лавуазье назвал поддерживающий горение газ oxygene — «образующий кислоты» (от греч. oxys — кислый и gennao — рождаю; отсюда и русское название «кислород»), так как он тогда считал, что все кислоты содержат кислород. Давно уже известно, что кислоты бывают как кислородсодержащими, так и бес кислородными, но название, данное элементу Лавуазье, осталось неизменным. На протяжении почти полутора веков 1/16 часть массы атома кислорода служила единицей сравнения масс различных атомов между собой и использовалась при численной характеристике масс атомов различных элементов (так называемая кислородная шкала атомных масс).

Но как получали раньше? Ранее кислород получали разложением бертолетовой соли KClO3 в присутствии каталитических количеств диоксида марганца MnO2 : 2KClO3 = 2KCl + 3О2.

При взаимодействии этих соединений с углекислым газом освобождается кислород: 2Na2O2 + 2CO2 = 2Na2CO3 + O2, 4КО2 + 2СО2 = 2К2СО3 + 3О2. Если использовать смесь Na2O2 и КО2, взятых в молярном отношении 1:1, то на каждый моль поглощенного из воздуха углекислого газа будет выделяться 1 моль кислорода, так что состав воздуха не будет изменяться за счет поглощения при дыхании кислорода и выделения СО2.

Особенности строения молекулы О2 Атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0,12074 нм. Молекулярный кислород (газообразный и жидкий) — парамагнитное вещество, в каждой молекуле О2 имеется по 2 не спаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному не спаренному электрону. Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кдж/моль.

Физические и химические свойства кипения жидкого кислорода При нормальных условиях плотность газа кислорода 1,42897 кг/м3. Температура кипения жидкого кислорода (жидкость имеет голубой цвет) –182,9°C. При температурах от –218,7°C до –229,4°C существует твердый кислород с кубической решеткой (a-модификация), при температурах от –229,4°C до –249,3°C — b-модификация с гексагональной решеткой и при температурах ниже –249,3°C — кубическая g-модификация.

Открытие кислорода. Кислород был открыт английским химиком Дж Пристли, который пытался выяснить, какие виды воздуха могут выделиться из различных химических веществ при их нагревании сфокусированными солнечными лучами

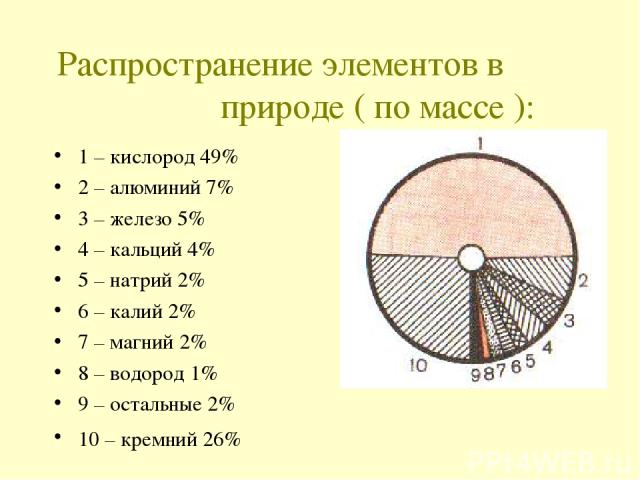
Распространение элементов в природе ( по массе ): 1 – кислород 49% 2 – алюминий 7% 3 – железо 5% 4 – кальций 4% 5 – натрий 2% 6 – калий 2% 7 – магний 2% 8 – водород 1% 9 – остальные 2% 10 – кремний 26%