Презентация на тему: Кислоты взаимодействие

КИСЛОТЫ Выполнила: Ученица 11 Б класса Веселухина Дарья 900igr.net

Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком Электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка Что такое кислоты?

Классификация кислот Признаки классификации Группы кислот Примеры Наличие кислорода в кислотном остатке А) кислородные; Б) бескислородные А) H3PO4, H2SO4; ,Б) HBr, H2S Основность А) одноосновные; Б) многоосновные А) HNO3, HCl; Б) H2SO4, H3PO4 Растворимость в воде А) растворимые; Б) нерастворимые А) HNO3, HCl; Б) H2SiO3 Летучесть А) летучие; Б) нелетучие А) H2S, HNO3 Б) H2SO4, H3PO4 Степень диссоциации А) сильные; Б) слабые А) HNO3, HCl; Б) H2SO3, H2CO3 Стабильность А) стабильные; Б) нестабильные А) H2SO4, HCl Б) H2SO3, H2CO3

Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с основаниями; Взаимодействие с солями. Химические свойства кислот далее

Диссоциация кислот HCl → HNO3→ H2SO4 → H3PO4 → НnКост → Н+ + Костn- H++ Cl- H+ + NO3- 2H+ + SO42- 3H+ + PO43- Обратно ко всем свойствам
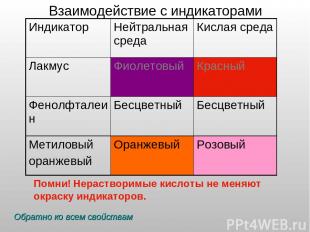
Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов. Обратно ко всем свойствам Индикатор Нейтральная среда Кислая среда Лакмус Фиолетовый Красный Фенолфталеин Бесцветный Бесцветный Метиловый оранжевый Оранжевый Розовый

Взаимодействие с металлами Ме + НnКост → МеnКостm+ Н2 металл + кислота→соль + водород 2 Al + 3 H2SO4 → 3 H2 Реакция возможна, если: Металл находится в ряду активности до водорода; В результате реакции получается растворимая соль; Кислота растворима Al2(SO4)3 + Обратно ко всем свойствам

Взаимодействие с основными оксидами МеxOy + HnКост → МеnКостy + H2O Основный оксид + кислота → соль + вода Реакция возможна, если в результате получается растворимая соль MgO + 2 HCl → MgCl2 + H2O MgO + 2H+ + 2Cl- → Mg2+ + 2Cl- + H2O MgO + 2H+ → Mg2+ + H2O Обратно ко всем свойствам

Взаимодействие с основаниями Ме(ОН)m + НnКост → MenКостm + H2O Основание + кислота → соль + вода NaOH + H3PO4→ Na3PO4 + 3 H2O 3 3Na+ + 3OH- + 3H+ + PO43- → 3Na+ + PO43- + 3H2O H+ + OH- → H2O Реакция между щелочью и кислотой с образованием соли и воды называется реакцией нейтрализации. Обратно ко всем свойствам

Взаимодействие с солями МеxКостy + HnКост → HхКост + МеnКостy Соль + кислота → новая кислота + новая соль Li2CO3 + H3PO4 → Li3PO4 + H2O + CO2 3 2 2 3 3 6Li+ + 3CO32- + 6H+ + PO43- → 6Li+ + 2PO43- + 3H2O + 3CO2 2H+ + CO32- → H2O + CO2 Реакция возможна, если в результате образуется осадок, газ или слабый электролит Обратно ко всем свойствам

Лимонная кислота содержится в лимонах. Яблочная- в яблоках. Щавелевая - в листьях щавеля. Муравьиная содержится в выделениях муравьев, пчелином яде и в жгучих волосках крапивы. Уксусная кислота образуется при скисании виноградного вина. Молочная – при скисании молока, квашении капусты и силосовании кормов для скота. Аскорбиновая( витамин С) - в черной смородине, малине, лимонах, апельсинах, томатах. Недостаток его в пище вызывает заболевание цынгу. Пищевые кислоты

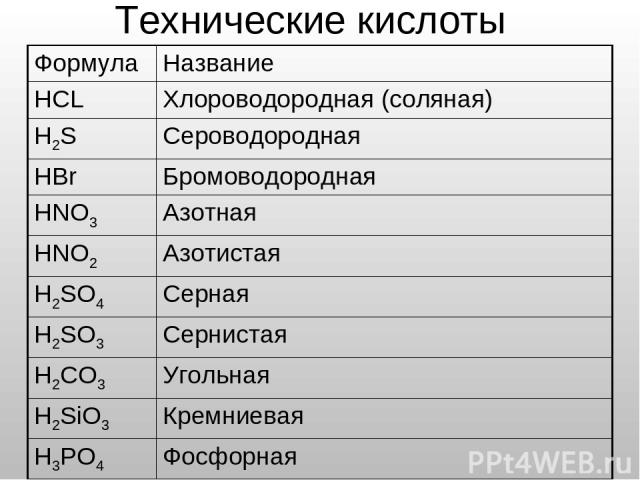
Технические кислоты Формула Название HCL Хлороводородная (соляная) H2S Сероводородная HBr Бромоводородная HNO3 Азотная HNO2 Азотистая H2SO4 Серная H2SO3 Сернистая H2CO3 Угольная H2SiO3 Кремниевая H3PO4 Фосфорная HF Фтороводородная (плавиковая)

Представители кислот Серная кислота Н2SО4 бесцветная вязкая жидкость, без запаха ,вдвое тяжелее воды, поглощает влагу из воздуха и других газов, обугливает древесину, кожу, ткани, бумагу. Для приготовления растворов запомните правило: Сначала вода, потом кислота, Иначе случится большая беда! По объему производства серной кислоты можно судить о развитии химической промышленности страны. Серную кислоту называют «Хлебом» химической промышленности, ее используют практически во всех отраслях народного хозяйства.

Соляная кислота Бесцветная, дымящаяся на воздухе жидкость, имеет специфический запах, несколько тяжелее воды. Содержится в желудке и выполняет две функции: 1) Уничтожает микробов, которые попадают в желудок вместе с пищей. 2) Помогает перевариванию пищи, так как входит в состав желудочного сока.

Немного загадок) нажмите! А точнее сказать одна!

Ну что ему та кислота? Как минеральная вода! Сто двадцать дней в ней просидел, Ни капли он не заржавел. ответ

ТИТАН

Спасибо!