Презентация на тему: Алкены - непредельные углеводороды

АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ.

Основное содержание лекции: Понятие о непредельных углеводородах. Характеристика двойной связи. Изомерия и номенклатура алкенов. Физические свойства. Получение алкенов. Свойства алкенов. Применение алкенов.

Понятие об алкенах Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а качественный и количественный состав выражается общей формулой СnН2n, где n ≥ 2. Алкены относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.

Характерис-тика двойной связи (С=С) Вид гибридизации – Валентный угол – Длина связи С = С – Строение ─ Вид связи – По типу перекрывания –
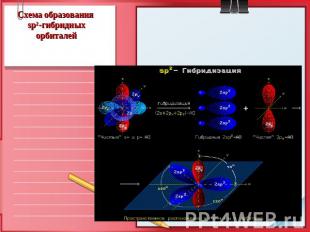
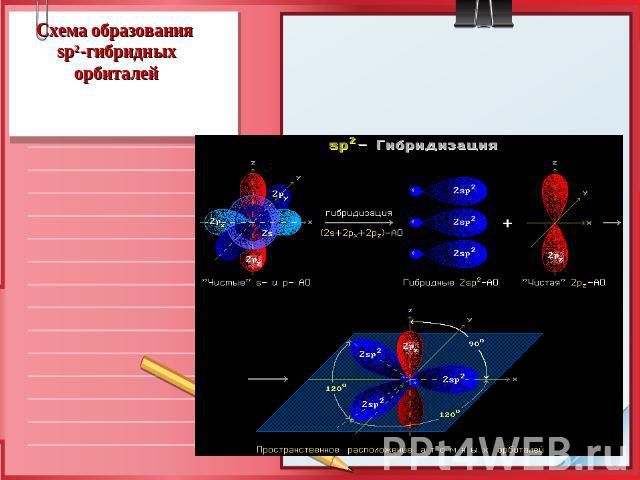
Схема образования sp2-гибридных орбиталей

Схема образования sp2-гибридных орбиталей

Гомологи-ческий ряд алкенов Общая формула СnН2n C2H4 C3H6 C4H8 C5H10 C6H12 C7H14

Изомерия алкенов Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия: углеродного скелета положения двойной связи межклассовая 2-ой тип – пространственная изомерия: геометрическая

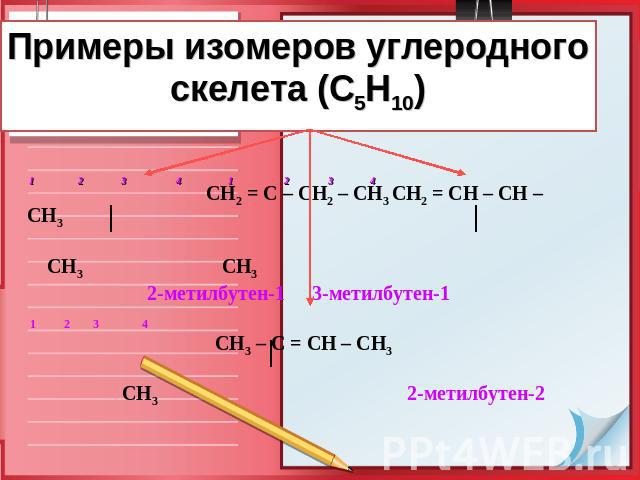
Примеры изомеров углеродного скелета (С5Н10) 1 2 3 4 1 2 3 4 СН2 = С – СН2 – СН3СН2 = СН – СН – СН3 СН3 СН3 2-метилбутен-1 3-метилбутен-1 1 2 3 4 СН3 – С = СН – СН3 СН3 2-метилбутен-2
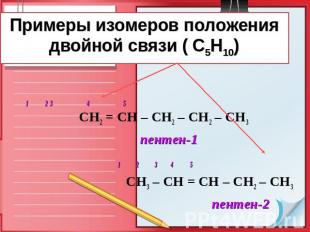
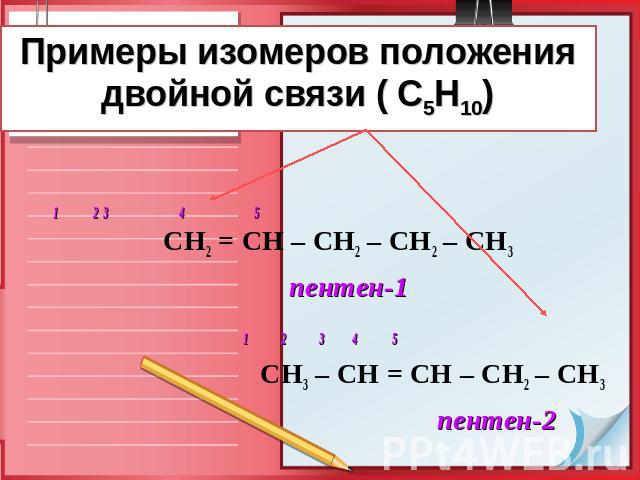
Примеры изомеров положения двойной связи ( С5Н10) 1 23 4 5 СН2 = СН – СН2 – СН2 – СН3 пентен-1 1 2 3 4 5 СН3 – СН = СН – СН2 – СН3 пентен-2
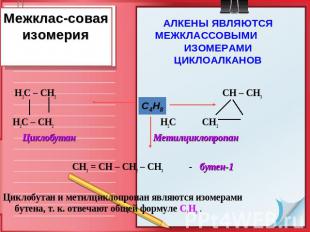
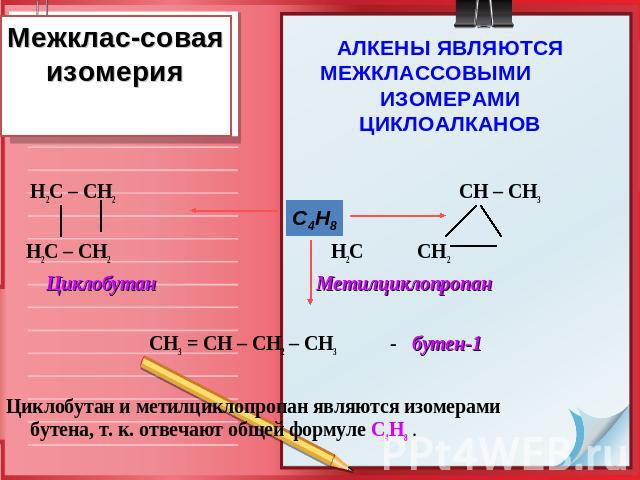
Межклас-совая изомерия Н2С – СН2 СН – СН3 Н2С – СН2 Н2С СН2 Циклобутан Метилциклопропан СН3 = СН – СН2 – СН3- бутен-1 Циклобутан и метилциклопропан являются изомерами бутена, т. к. отвечают общей формуле С4Н8 . АЛКЕНЫ ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИ ИЗОМЕРАМИ ЦИКЛОАЛКАНОВ
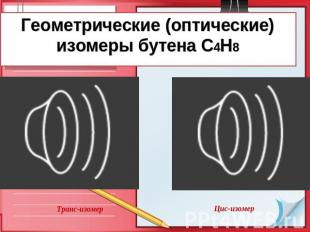
Геометрические (оптические) изомеры бутена С4Н8
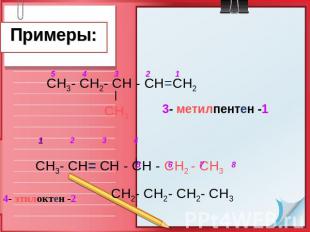
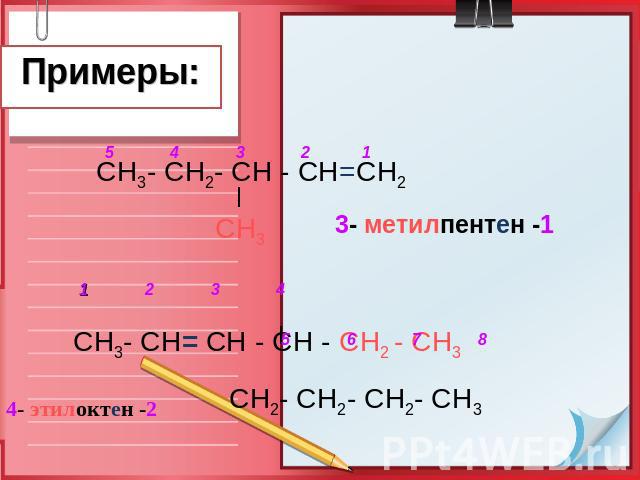
Примеры: СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН - СН2 - СН3 СН2- СН2- СН2- СН3

Физические свойства алкенов С2– С4 - газы С5– С16 - жидкости С17… - твёрдые вещества Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
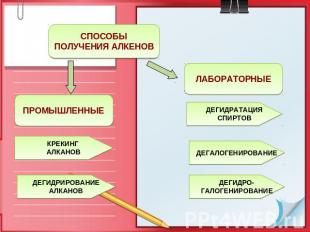
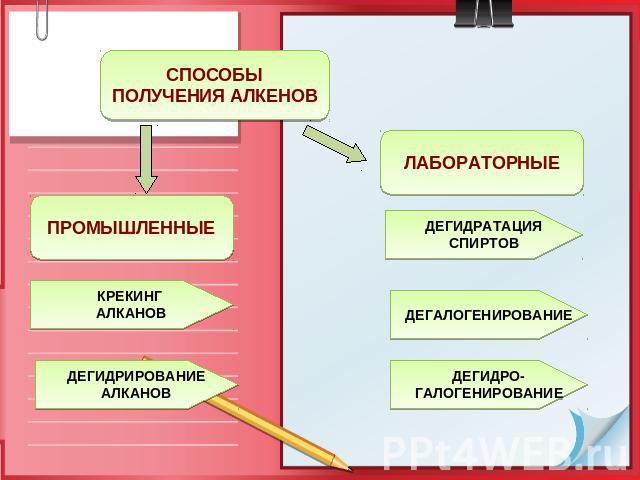
СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ПРОМЫШЛЕННЫЕ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
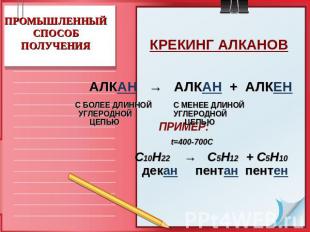
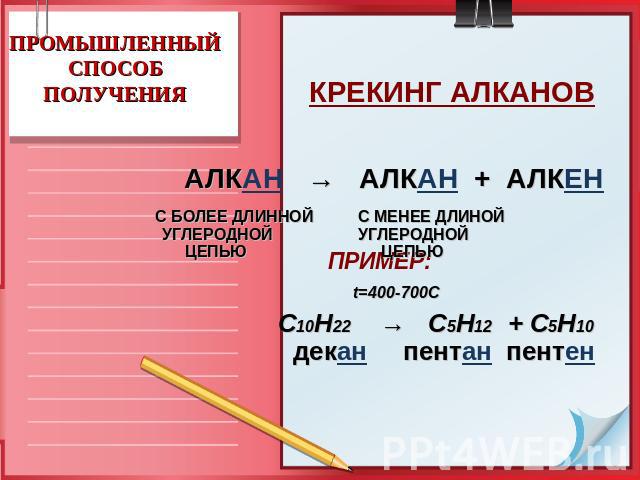
ПРОМЫШЛЕННЫЙСПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ ПРИМЕР: t=400-700C С10Н22 → C5H12 + C5H10 декан пентан пентен АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ УГЛЕРОДНОЙ УГЛЕРОДНОЙ ЦЕПЬЮ ЦЕПЬЮ
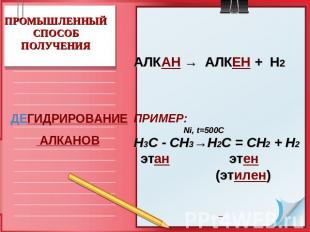
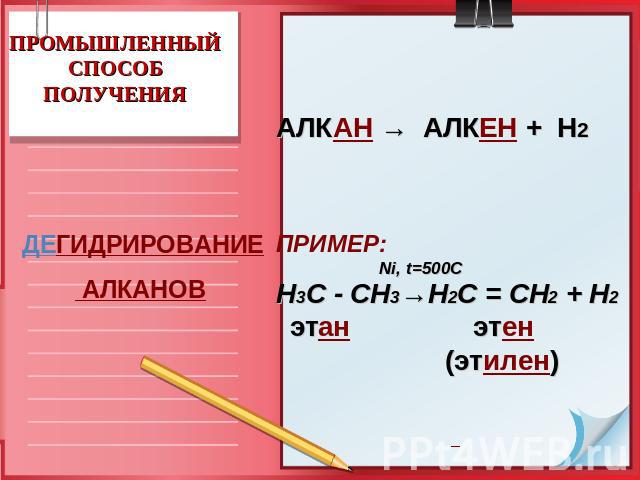
ПРОМЫШЛЕННЫЙСПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + Н2 ПРИМЕР: Ni, t=500C Н3С - СН3→Н2С = СН2 + Н2 этан этен (этилен)
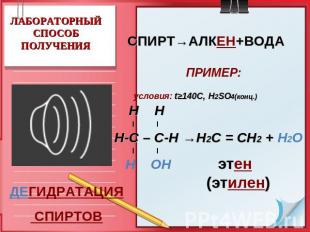
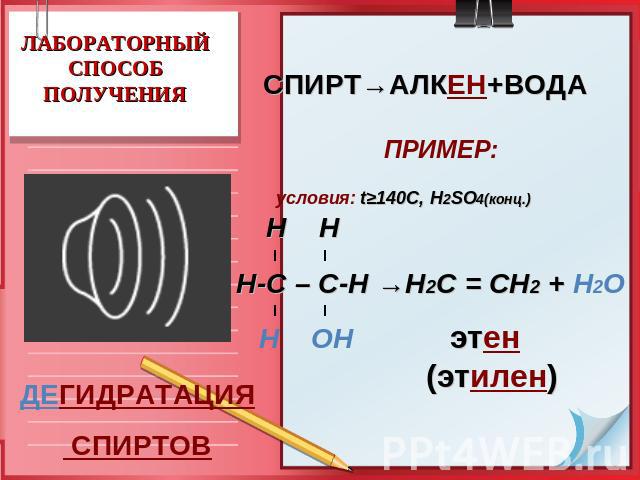
ЛАБОРАТОРНЫЙСПОСОБ ПОЛУЧЕНИЯ СПИРТ→АЛКЕН+ВОДА ПРИМЕР: условия: t≥140C, Н2SO4(конц.) Н Н Н-С – С-Н →Н2С = СН2 + Н2О Н ОН этен (этилен) ДЕГИДРАТАЦИЯ СПИРТОВ

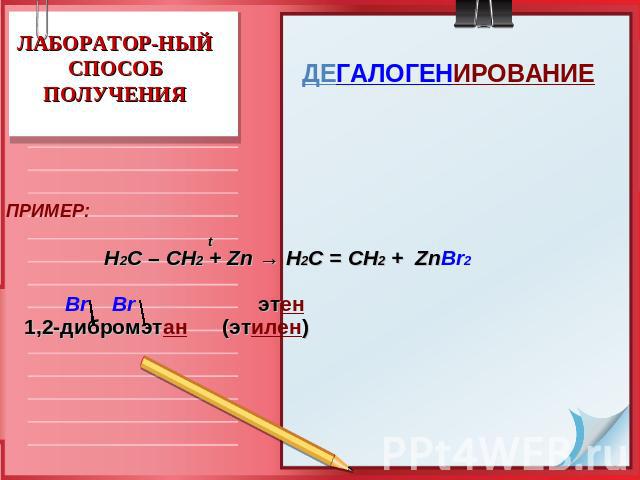
ЛАБОРАТОР-НЫЙСПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2 Br Br этен 1,2-дибромэтан (этилен)
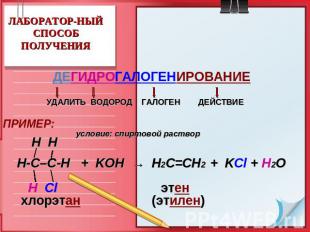
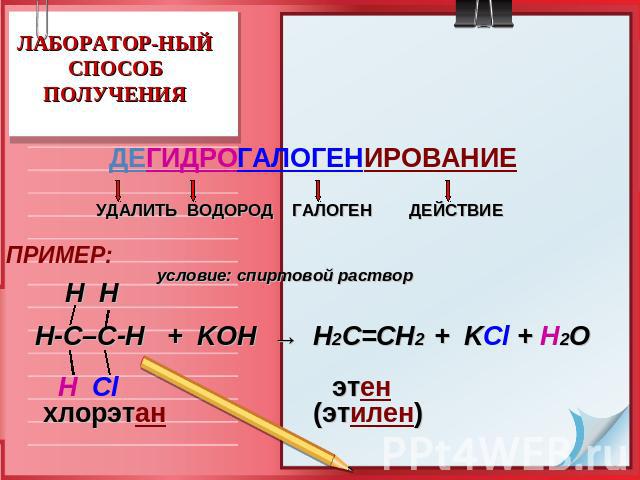
ЛАБОРАТОР-НЫЙСПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: условие: спиртовой раствор H H Н-С–С-Н + KOH → Н2С=СН2 + KCl + H2O Н Cl этен хлорэтан (этилен)
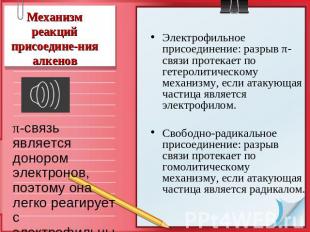
Механизм реакций присоедине-ния алкенов π-связь является донором электронов, поэтому она легко реагирует с электрофильными реагентами. Электрофильное присоединение: разрыв π-связи протекает по гетеролитическому механизму, если атакующая частица является электрофилом. Свободно-радикальное присоединение: разрыв связи протекает по гомолитическому механизму, если атакующая частица является радикалом.
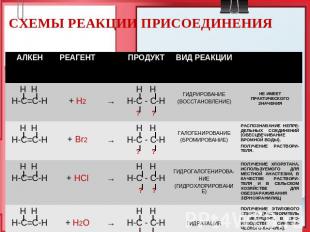
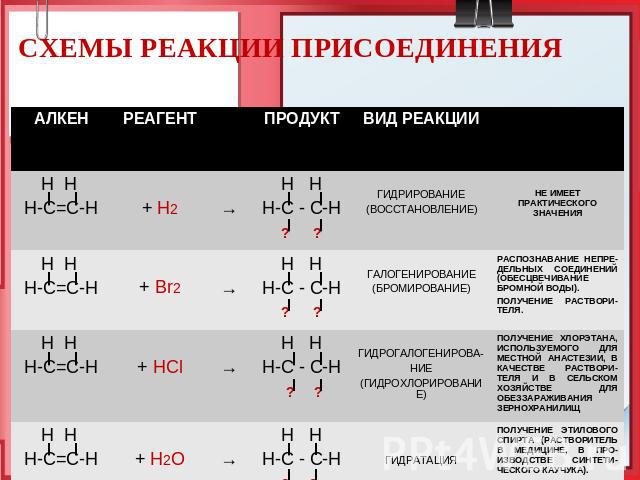
СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен (мономер) (полимер) n– степень полимеризации, показывает число молекул, вступивших в реакцию -CH2-CH2- структурное звено
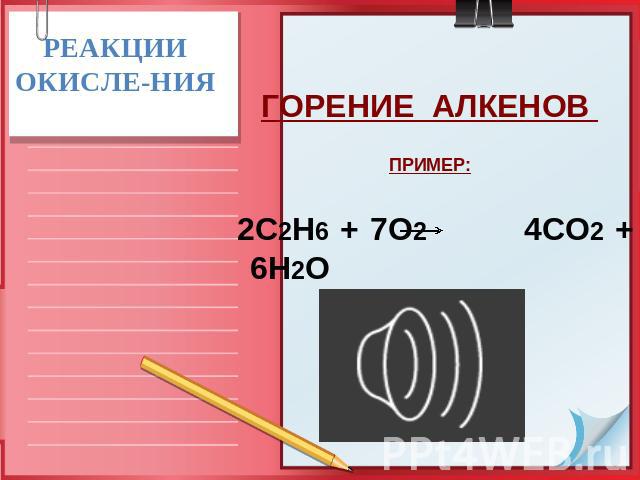
РЕАКЦИИ ОКИСЛЕ-НИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2С2Н6 + 7О2 4СО2 + 6Н2О

РЕАКЦИИ ОКИСЛЕ-НИЯ Реакция Е.Е.Вагнера МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь.
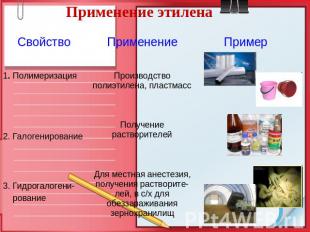
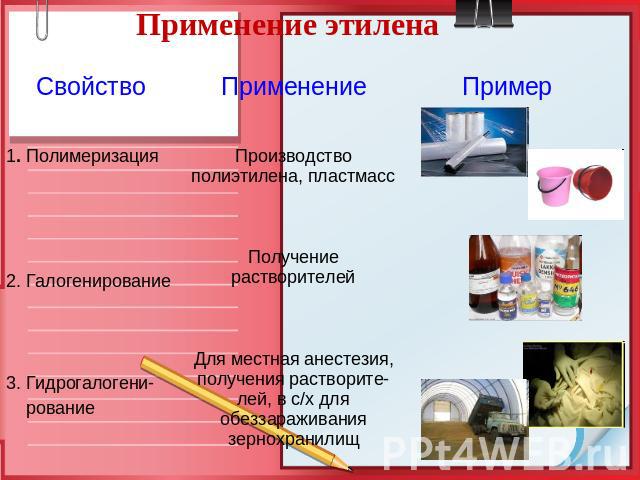
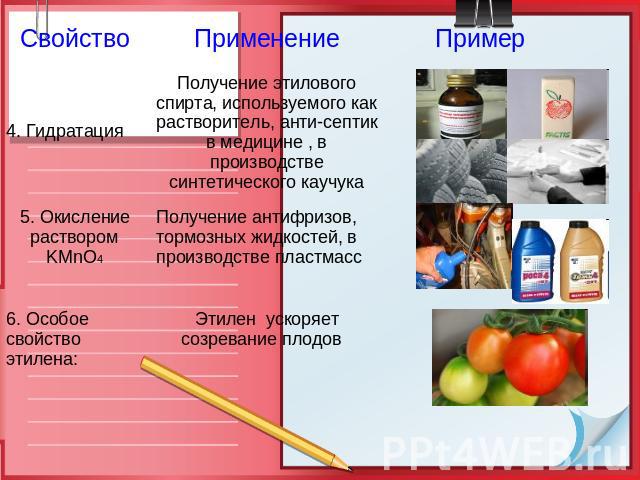
Применение этилена

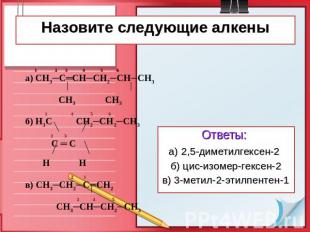
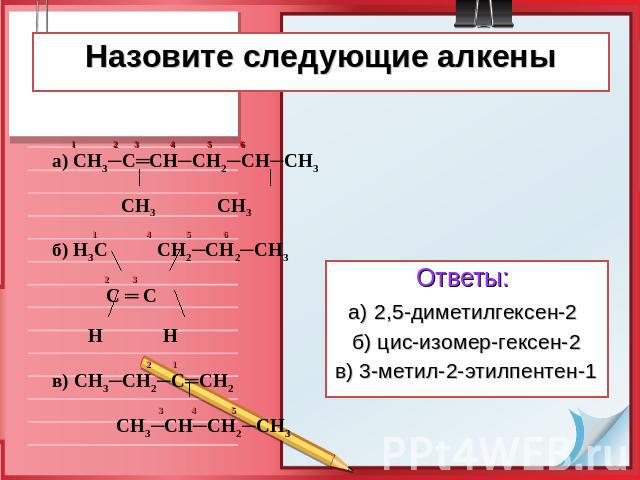
Назовите следующие алкены 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С СН2─СН2─СН3 2 3 С ═ С Н Н 2 1 в) СН3─СН2─С═СН2 3 4 5 СН3─СН─СН2─СН3 Ответы: а) 2,5-диметилгексен-2 б) цис-изомер-гексен-2 в) 3-метил-2-этилпентен-1

Используя правило Марковникова, напишите уравнения следующих реакций присоединения: а) СН3-СН=СН2 + НСl ? б) СН2=СН-СН2-СН3 + НBr ? В) СН3-СН2-СН=СН2 + НОН ? Ответы: а) СН3-СН=СН2 + НСl СН3-СНCl-СН3 б) СН2=СН-СН2-СН3 + НBr СН3-СНBr-СН2-СН3 в) СН3-СН2-СН=СН2 + НОН СН3-СН2-СН-СН3 ОН

ДОМАШНЕЕ ЗАДАНИЕ Оценка «3»: параграф 4, ТПО стр. 24-25, № 5-7 Оценка «4»: Хомченко И.Г.: 20.21 Оценка «5»: Составить цепочку превращений, используя материал по темам «Алканы» и «Алкены»

СПАСИБО ЗА РАБОТУ!











![РЕАКЦИИ ОКИСЛЕ-НИЯ Реакция Е.Е.Вагнера МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь. РЕАКЦИИ ОКИСЛЕ-НИЯ Реакция Е.Е.Вагнера МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь.](/images/150/7746/640/img24.jpg)