Презентация на тему: Свойства металлов

Металлы МОУ ООШ п. Пудожгорский, Гараева Елена Витальевна 900igr.net

План реферата Положение металлов в периодической системе Д.И. Менделеева. Строение атомов металлов, кристаллических решеток. Физические свойства металлов. Общие химические свойства. Электрохимический ряд напряжения. Коррозия металлов. Сплавы. Металлы в природе, общие способы их получения.

Положение металлов в П.С. Если в П. С. элементов Д. И. Менделеева провести диагональ от бериллия (Be) к астату (At), то справа вверх от диагонали будут находиться элементы-неметаллы (исключая элементы побочных подгрупп), а слева внизу – элементы-металлы (к ним также относятся элементы побочных подгрупп). Элементы, расположенные вблизи диагонали (например, бериллий Be, алюминий Al, титан Ti, германий Ge, ниобий Nb, сурьма Sb и др.), обладают двойственным характером. Как видно, наиболее типичные элементы-металлы расположены в начале периодов (начиная со второго). Таким образом из 113 элементов 85 являются металлами.

В древности и в средние века были известны только семь металлов. Это число соотносилось с числом известных тогда планет: Солнце (золото), Юпитер (олово), Луна (серебро), Марс (железо), Меркурий (ртуть), Сатурн (свинец), Венера (медь). Алхимики считали, что под влиянием лучей планет в недрах Земли рождаются эти металлы.

Периодическая система Д. И. Менделеева
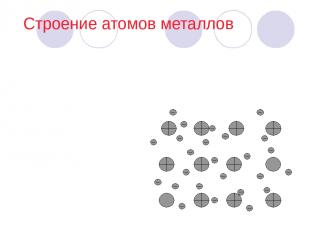
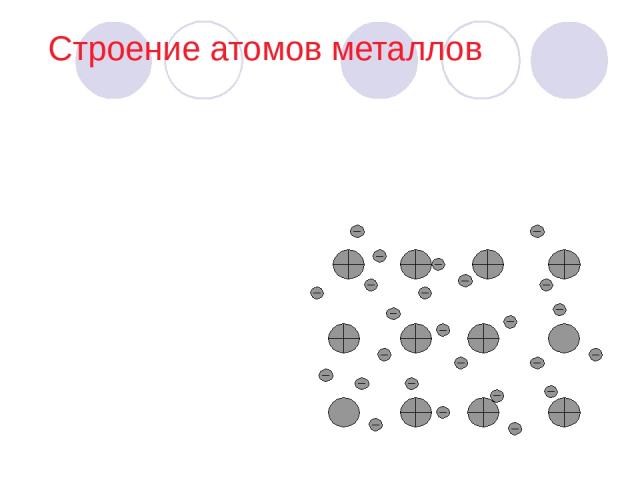
Строение атомов металлов Кристаллические решетки, в узлах которых находятся положительно заряженные ионы и некоторое число нейтральных атомов, между которыми передвигаются относительно свободные электроны, называют металлическими. Связь, которую осуществляют эти относительно свободные электроны между ионами металлов, образующих кристаллическую решетку, называют металлической.

У атомов металлов на наружном энергетическом уровне обычно находится от одного до трех электронов. Их атомы обладают большим радиусом. Металлы являются сильными восстановителями, так как легко отдают наружные электроны. Поэтому атомы металлов превращаются в положительно заряженные ионы. Так как электроны находятся в непрерывном движении, то при их столкновении с положительно заряженными ионами последние превращаются в нейтральные атомы, а затем вновь в ионы. Строение атомов (продолжение)

Строение атомов Ме (продолжение) Ме главных подгрупп на внешнем уровне имеют 1-3 электрона (4 электрона имеют металлы IV группы). Ме главных подгрупп завершают внешний уровень, отдавая электроны. Ме побочных подгрупп. Предвнешний уровень незавершенный, внешний уровень имеет 1-2 электрона; завершают внешний уровень, отдавая электроны, степень окисления: +1; +2; +3; (+4). Все металлы - восстановители
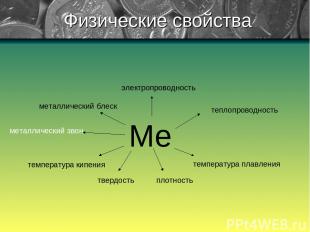
Физические свойства
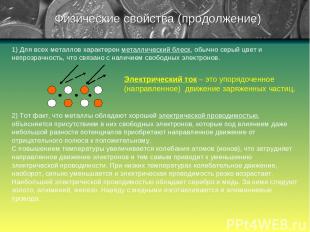
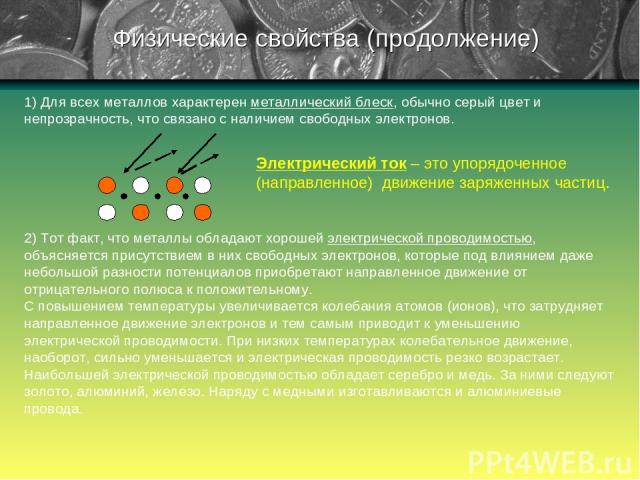
1) Для всех металлов характерен металлический блеск, обычно серый цвет и непрозрачность, что связано с наличием свободных электронов. 2) Тот факт, что металлы обладают хорошей электрической проводимостью, объясняется присутствием в них свободных электронов, которые под влиянием даже небольшой разности потенциалов приобретают направленное движение от отрицательного полюса к положительному. С повышением температуры увеличивается колебания атомов (ионов), что затрудняет направленное движение электронов и тем самым приводит к уменьшению электрической проводимости. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость резко возрастает. Наибольшей электрической проводимостью обладает серебро и медь. За ними следуют золото, алюминий, железо. Наряду с медными изготавливаются и алюминиевые провода. Физические свойства (продолжение) Электрический ток – это упорядоченное (направленное) движение заряженных частиц.

Физические свойства (продолжение) 3) В большинстве случаев при обычных условиях теплопроводность металлов изменяется в такой же последовательности, как и их электрическая проводимость. Теплопроводность обуславливается высокой подвижностью свободных электронов и колебательными движениями атомов, благодаря чему происходит быстрее выравнивание температур в массе металлов. Наибольшая теплопроводность – у серебра, и меди, наименьшая – у висмута и ртути.

4) Механическое воздействие на кристалл с ковалентной связью вызывает смещение отдельных слоев атомов, в результате чего связи разрываются и кристалл разрушается. Такое же воздействие на кристалл с металлической связью вызывает смещение слоев атомов, однако, благодаря перемещению электронов по всему кристаллу, разрыв связей не происходит. Для металлов характерна высокая пластичность. Она уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe. Золото, например, можно прокатывать в листы толщиной не более 0,003 мм, которые используются для позолоты различных предметов. Физические свойства (продолжение)

5) Различна плотность металлов. Она тем меньше, чем меньше атомная масса элемента-металла и чем больше радиус его атома. Самый легкий из металлов – литий (плотность = 0,53 г/см³ ), самый тяжелый – осмий (плотность = 22,6 г/см³). Металлы с плотностью меньше 5 г/см³ – легкие, остальные – тяжелые. Физические свойства (продолжение)

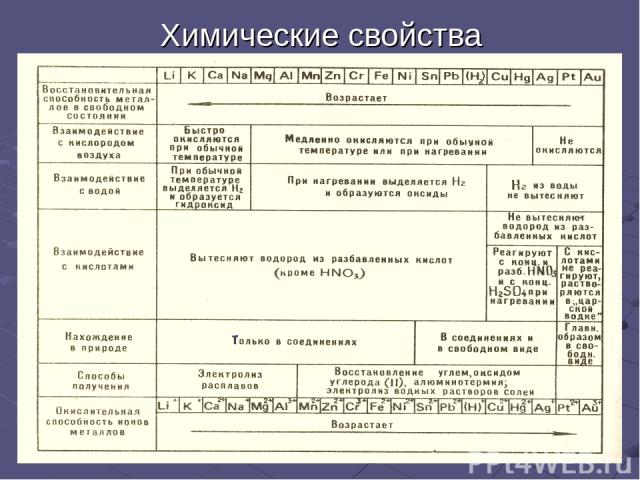
Химические свойства

Общие химические свойства (продолжение) Наиболее энергично металлы реагируют с простыми веществами (неметаллами): галогенами кислородом серой Ca - восстановитель Mg - восстановитель Na - восстановитель

Общие химические свойства 1) Взаимодействие металлов с кислотами есть окислительно-восстановительный процесс. Окислителем является ион водорода, который принимает электроны от металла: 2) Взаимодействие металлов с растворами солей менее активных металлов можно иллюстрировать примером действия железа на раствор сульфата меди. В этом случае происходит отрыв электронов от атомов более активного металла (железо) и присоединение их ионами менее активного (меди). 3) Активные металлы взаимодействуют с водой, которая выступает в роли окислителя.

4) Металлы, гидроксиды которых амфотерны, как правило взаимодействуют с растворами и кислот, и щелочей. Главное химическое свойство металлов – они являются восстановителями. 5) Металлы могут образовывать химические соединения между собой. Они имеют общее название – интерметаллические соединения или интерметаллиды. Примером могут служить соединения некоторых металлов с сурьмой: Na2Sb, Ca3Sb, NiSb, Ni4Sb, FeSbx (х = 0,72 – 0,92). В них чаще всего не соблюдаются степени окисления, характерные в соединениях с неметаллами. Общие химические свойства

Общие химические свойства (продолжение) Металлы могут окисляться также ионами водорода и ионами других металлов. Металлы реагируют со сложными веществами: водой: кислотами: растворами солей: Na - восстановитель Fe - восстановитель Zn - восстановитель

Электрохимический ряд напряжения Этот ряд называется электрохимическим рядом напряжения. Энергия ионизации, определяется положением металла в периодической системе. В электрохимическом ряду напряжения металл, стоящий левее, может вытеснить из растворов или расплавов солей металл, стоящей правее. Пользуясь этим рядом, можно предсказать, как Ме будет себя вести в паре с другим. В электрохимический ряд напряжения включен также водород. Это позволяет сделать заключение о том, какие Ме могут вытеснить водород из растворов кислот. Так , например, железо вытесняет водород из растворов кислот, так как находится левее его; медь же не вытесняет водород, так как находится правее его.

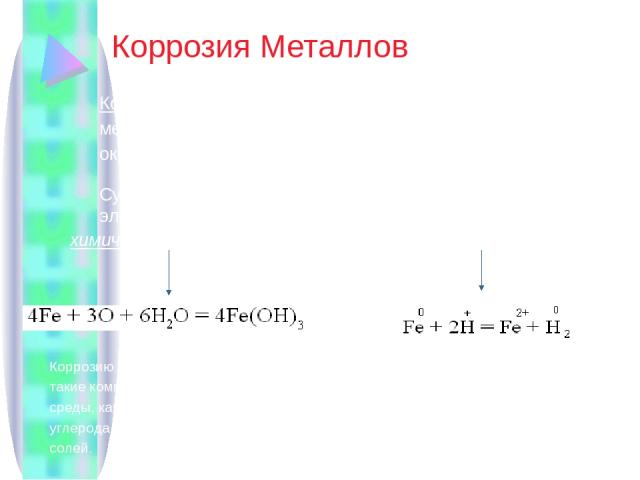
Коррозия Металлов Коррозия – это химическое и электрохимическое разрушение металлов и их сплавов в результате воздействия на них окружающей среды. Существует два вида коррозии: химическая и электрохимическая. химическая коррозия Электрохимическая коррозия Коррозию Ме и их сплавов вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, водные растворы солей. Более активный Ме при электрохимической коррозии разрушается, переходя в воду, тем самым предохраняя менее активный Ме от разрушения.
Методы борьбы с коррозией

Сплавы Сплавы обладают такими свойствами, которые не имеют образующие их металлы. Получение сплавов основано на способности расплавленных Ме растворяться в друг друге. При охлаждении образуются сплавы с нужными свойствами: легкоплавкие, жаростойкие, кислостойкие и т.д. Сплавы – это материалы с характерными свойствами, состоящие из двух или более компонентов, из которых по крайней мере один – металл. Сплавы однородные неоднородные при сплавлении образуется раствор одного Ме в другом. Припой: одна часть свинца и две части олова при сплавлении образуется механическая смесь Ме Дюралюмин: 95% алюминия, 4% меди, 0,5% марганца и 0,5% магния

Сплавы (продолжение) В современной технике наибольшее применение находят сплавы железа. Так, например, в машиностроении на их долю приходится 90 % от общей массы применяемых металлов. Важнейшими сплавами железа являются чугун и сталь. Чугун – это сплав железа, содержащий более 1,7 % углерода, а также кремний, марганец, небольшие количества серы и фосфора. Сталь - это сплав железа, содержащий 0,1-2 % углерода и небольшие количества кремния, марганца, фосфора и серы.
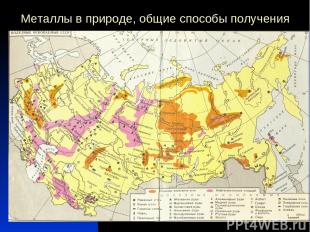
Металлы в природе, общие способы получения

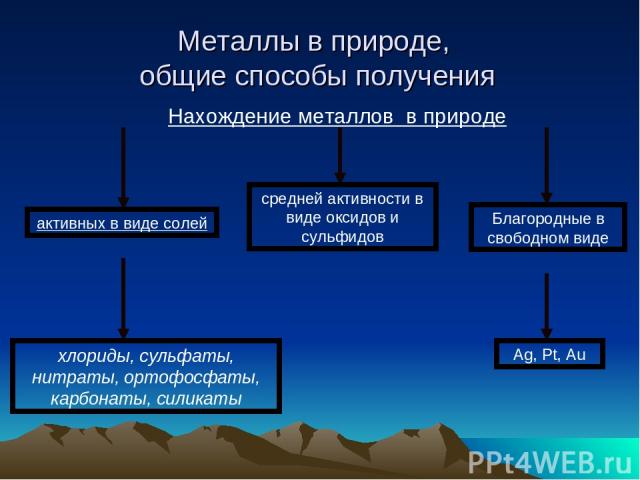
Металлы в природе, общие способы получения Самым распространенным Ме в земной коре является алюминий. За ним следует железо, натрий, калий, магний и титан. Содержание остальных металлов незначительно. Так, например, хрома в земной коре по массе всего лишь 0,3%, никеля – 0,2%, а меди – 0,01%. Ме встречаются в природе как в свободном виде, так и в различных соединениях боксит гематит магнетит Пудожгорский Костомукша Север Карелии

Металлы в природе Самородок платины Самородок серебра Самородок золота нефелин

Наиболее активные Ме получают электролизом. Менее активные Ме восстанавливают из их оксидов (приведем несколько примеров): 2. Обжиг сульфидов Ме с последующим восстановлением образовавшихся оксидов: 3. Восстановление Ме из их оксидов более активными Ме: 1. Восстановление Ме из их оксидов углем или оксидом углерода (II):
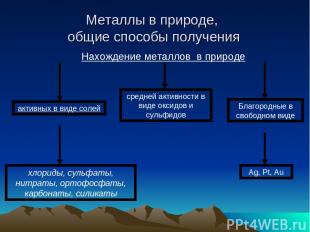
Металлы в природе, общие способы получения

Применение алюминия

Применение титана