Презентация на тему: Свойства воды

900igr.net

Девиз урока: Вода – это жизнь!

22 марта — Всемирный день водных ресурсов по календарю ООН, День воды.

Аквариум, Акватория, Акваланг, Акварель.
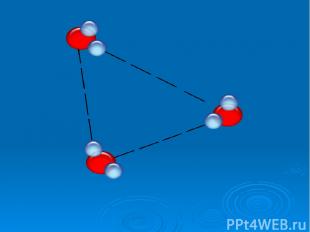
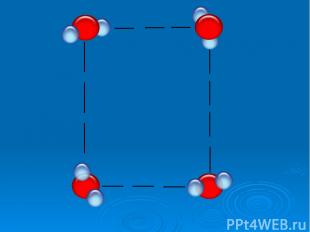
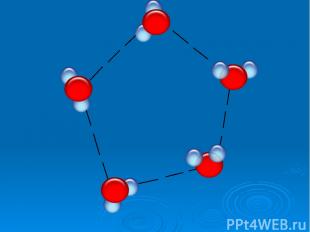

Исследование свойств воды

№1. Вода в природе Велики ли запасы воды на нашей планете? 2. Чего больше на Земле — соленой или пресной воды? 3. Где сосредоточены основные запасы пресной воды?


Сколько воды на нашей планете? Общие мировые запасы воды во всех её агрегатных состояниях огромны. Вода относится к числу наиболее распространённых в природе веществ. Общее её количество составляет 1,4 ∙1018 т, она покрывает примерно 4/5 площади земной поверхности. Если бы разделить её поровну, то на каждого жителя планеты пришлось бы по 280 млрд л. Однако, 97% водных ресурсов приходится на долю океанов.

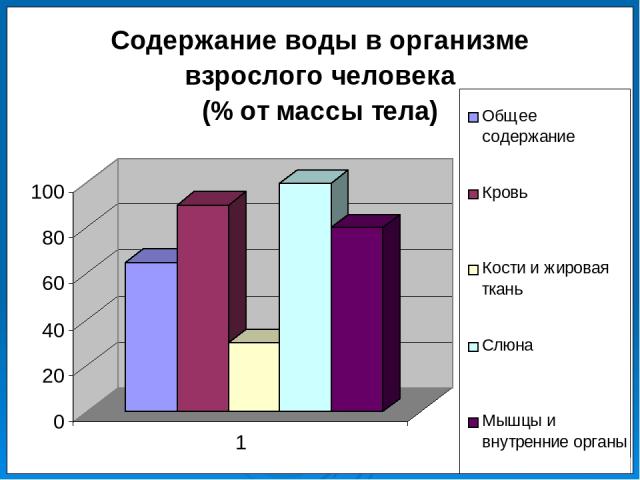
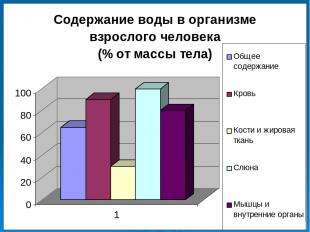
№2 Значение воды для жизни организмов 1. Какова роль воды в организме человека? 2. Зависит ли количество воды в организме от возраста?

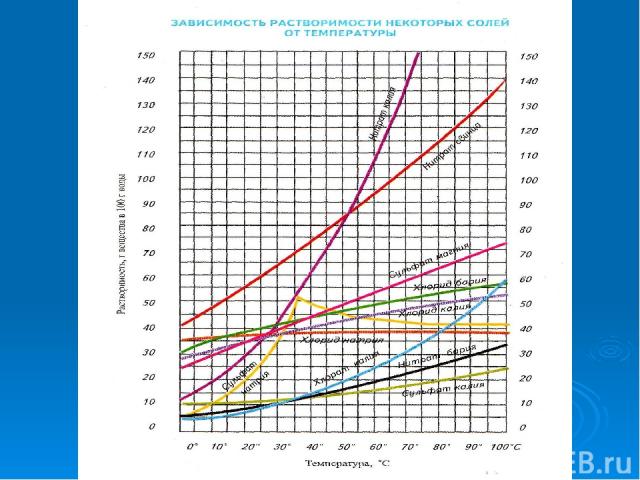
№3 Вода — растворитель Почему воду называют универсальным растворителем? 2. Какой величиной характеризуется способность веществ растворяться в воде? 3. Растворимость зависит от температуры?
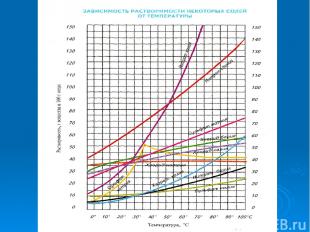

№4 Химики-экспериментаторы Растворимость зависит от температуры? От чего еще зависит растворимость ?

Особые свойства воды Видео-1 Видео-2

№5 Особые свойства воды Какое свойство воды спасает нашу планету от оледенения? 2. При какой температуре у воды максимальная плотность? 3. К каким важным последствиям приводит эта аномалия?

Химические свойства воды Она необходима нам всегда. И юный химик, верно, пожелает Узнать, с чем реагирует вода И как она в реакции вступает.

Взаимодействие воды с простыми веществами Опишет наша первая глава Процессы водорода замещения, И как с водой простые вещества Вступают в непростые отношения.

1. Реакции воды с металлами Кусочек лития пинцетом взят. Отметьте, что условия обычны. Опустим в воду — тут же результат: Пошла реакция, она экзотермична. Вмиг из воды наш щелочной металл Газ водород активно вытесняет, А тот, ликуя, что свободным стал, Шипит и литий по воде гоняет. Кружит металл, как шаловливый пес, Как будто за хвостом своим гоняясь, Потерю электронов перенес, С гидроксогруппой в щелочь превращаясь: 2 Li + 2 HOH = 2 LiOH + H2 + Q. А индикатор проливает свет На появленье оснований сильных: Раствор в малиновый окрасив цвет, Групп подтвердит наличие гидроксильных.

2. Реакции воды с неметаллами И неметаллы могут вытеснять Газ водород из водяного пара. К примеру, угольки мы можем взять. Но предварительно задав им жару: С + Н2О = СО + Н2.

Взаимодействие воды со сложными веществами Поговорим о сложных веществах. С оксидами сначала разберемся. Причем практически, не на словах Взаимодействия с водой коснемся.

1. Реакции воды с основными оксидами К оксиду кальция воды прилить Вмиг в гидроксид случится превращение. Так мы «пушонку» можем получить, Ведь происходит извести гашение: СаО + Н2O = Са(ОН)2 + Q.

В природе есть железная руда, Железняки — основные оксиды. Так вот, не растворяет их вода. Но мы не держим на нее обиды: Fe2O3 + H2O = Fe3O4 + H2O = Оксид железа (II, III) - магнитный железняк, оксид железа (III) – красный железняк.

2. Реакции воды с кислотными оксидами Нам так приятен летнею порой Вкус кислый газированной водицы! А обусловлен он, представьте, кислотой, И знать реакцию вам пригодится. Оксид кислотный — углекислый газ — С водой соединяется охотно. Хоть воду эту пили мы не раз, Не думали, что пьем раствор кислотный. CO2 + H2O = H2CO3

А под ногами нашими песок — Оксид кислотный. Только он едва ли С водой соединиться мог, Не то бы мы по кислоте шагали: Н2О + SiO2 =

Так как же общий вывод прозвучит? У вас уже есть опыт ощутимый: С водой соединяется оксид, Когда продукт реакций — растворимый.
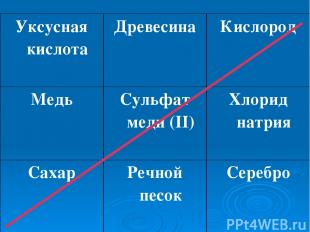
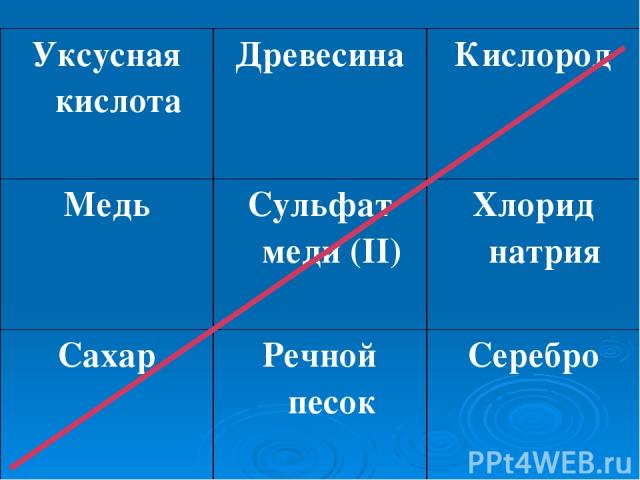
Уксусная кислота Древесина Кислород Медь Сульфат меди (II) Хлорид натрия Сахар Речной песок Серебро
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15