Презентация на тему: Производство серной кислоты

Производство серной кислоты Запоминай-ка! Автор: Кулаева Галина Николаевна, учитель химии МБОУ СОШ с. Троицкого Моздокского района РСО-Алания

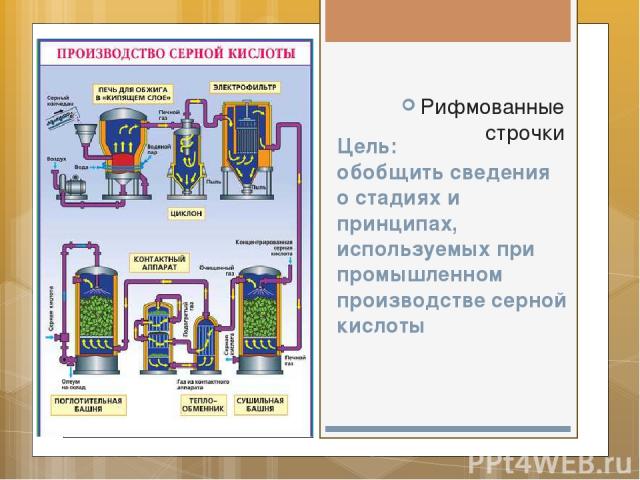
Цель: обобщить сведения о стадиях и принципах, используемых при промышленном производстве серной кислоты Рифмованные строчки

Для закрепления сейчас Начну рифмованный рассказ, Чтоб производство кислоты Сумел легко запомнить ты!

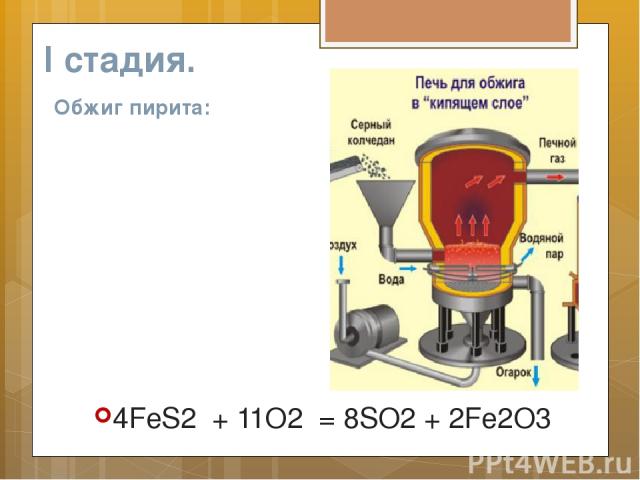
Сырьем для производства служит пирит – железный колчедан

Чтоб выше выход был продукта, , Он измельченным в печь подан.
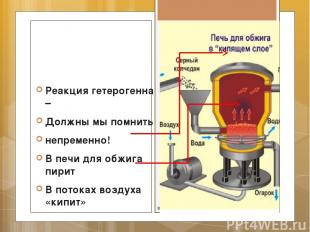
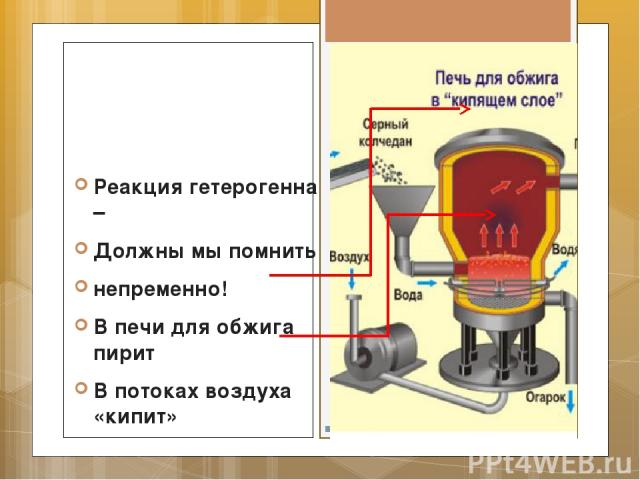
Реакция гетерогенна – Должны мы помнить непременно! В печи для обжига пирит В потоках воздуха «кипит»
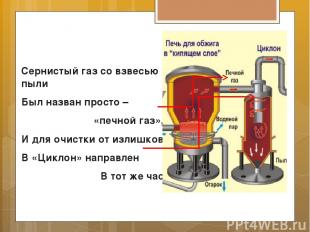
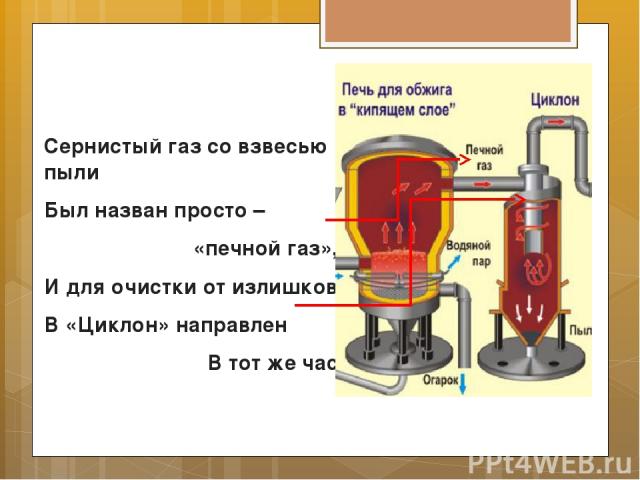
Сернистый газ со взвесью пыли Был назван просто – «печной газ», И для очистки от излишков В «Циклон» направлен В тот же час.

Там крутит-вертит центрифуга, И пыль, под тяжестью своей, На дно «Циклона» оседает: в реакции нет места ей!
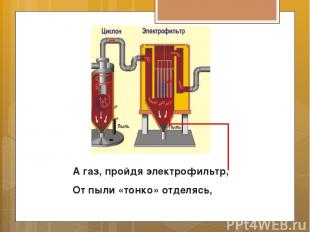
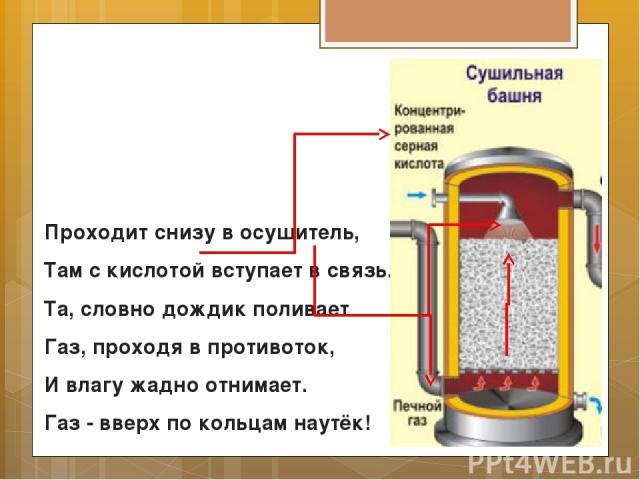
А газ, пройдя электрофильтр, От пыли «тонко» отделясь,

Проходит снизу в осушитель, Там с кислотой вступает в связь. Та, словно дождик поливает Газ, проходя в противоток, И влагу жадно отнимает. Газ - вверх по кольцам наутёк!
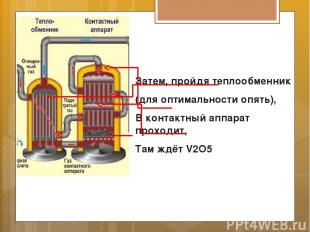
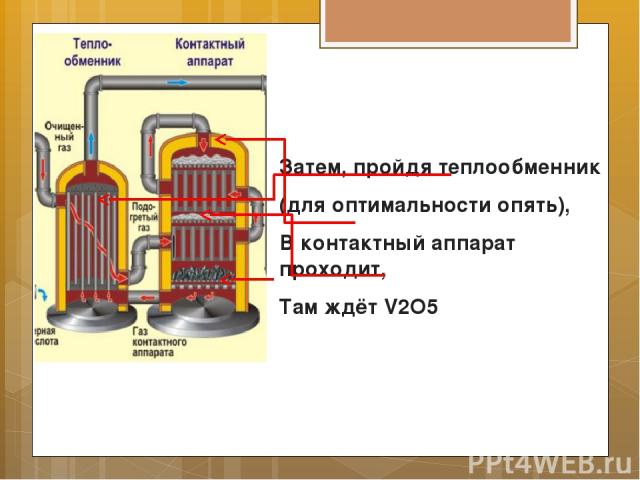
Затем, пройдя теплообменник (для оптимальности опять), В контактный аппарат проходит, Там ждёт V2O5
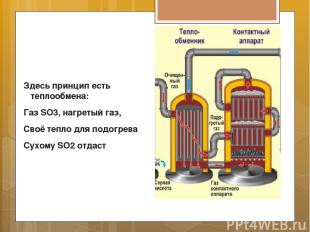
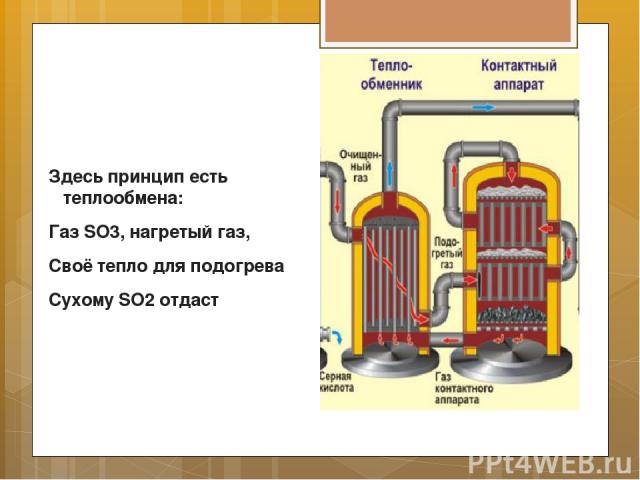
Здесь принцип есть теплообмена: Газ SO3, нагретый газ, Своё тепло для подогрева Сухому SO2 отдаст
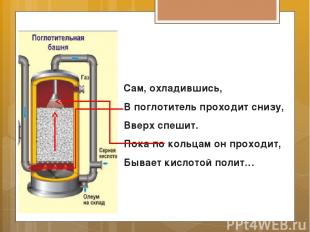
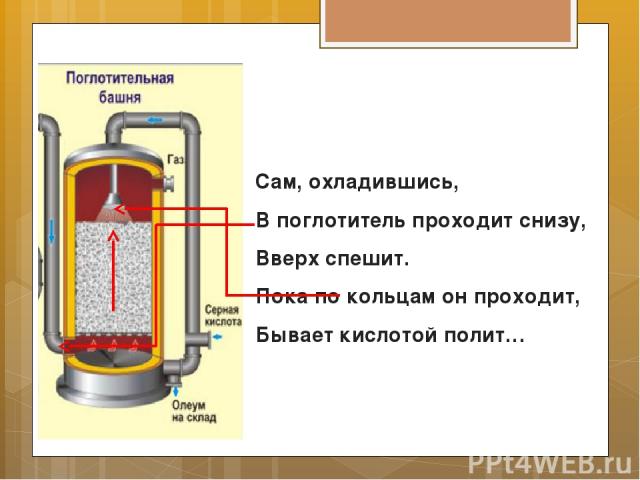
Сам, охладившись, В поглотитель проходит снизу, Вверх спешит. Пока по кольцам он проходит, Бывает кислотой полит…

Известно: SO3 с водою должны стать серной кислотою! SO3 + H2O = H2SO4 Но так в промышленном масштабе Не получают никогда! Такое может ведь случиться: Вода вмиг в пар вся превратится, Такая будет экзотерма, Что прямо скажем мы: беда!
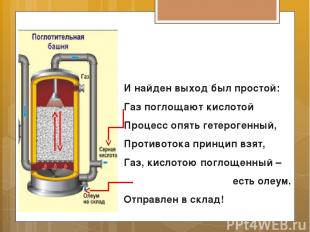
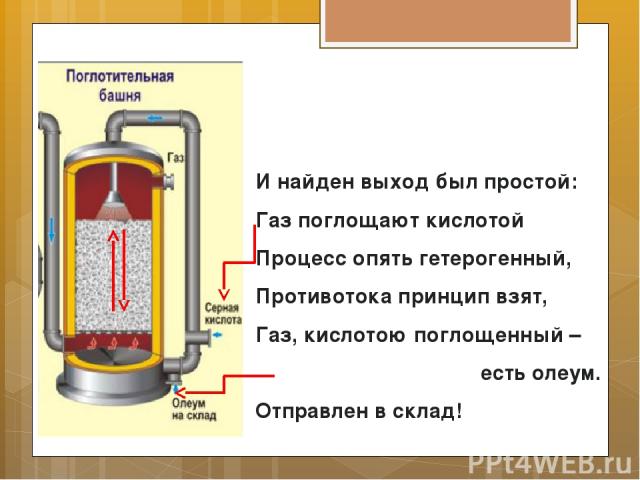
И найден выход был простой: Газ поглощают кислотой Процесс опять гетерогенный, Противотока принцип взят, Газ, кислотою поглощенный – есть олеум. Отправлен в склад!

Ещё раз, в целом, схему рассмотрите Затем в своих тетрадях запишите, Те стадии и принципы, которые взяты для производства серной кислоты ,
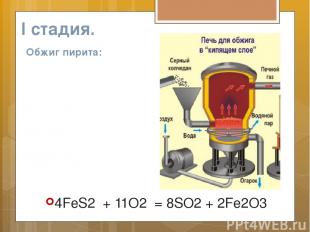
I стадия. Обжиг пирита: 4FeS2 + 11O2 = 8SO2 + 2Fe2O3

II стадия. Окисление сернистого газа над катализатором: 2SO2 + O2 V2O5→ 2SO3

III стадия. Поглощение серного ангидрида концентрированной серной кислотой H2SO4 + nSO3 = H2SO4∙nSO3

Спасибо за урок!

Используемые интернет-ресурсы http://www.mitht.rssi.ru/2008/equipment/mediana_ch/images/1-6-4.jpg http://rpp.nashaucheba.ru/pars_docs/refs/24/23623/img2.jpg http://rpp.nashaucheba.ru/pars_docs/refs/24/23623/img3.jpg http://bushuew.ru/images/FotoStaty/Statyi/Pirit.jpg http://img-fotki.yandex.ru/get/6409/22271788.446/0_9ec37_736490fa_XL