Презентация на тему: Производство серной кислоты (польза и вред)

Производство серной кислоты (польза и вред)

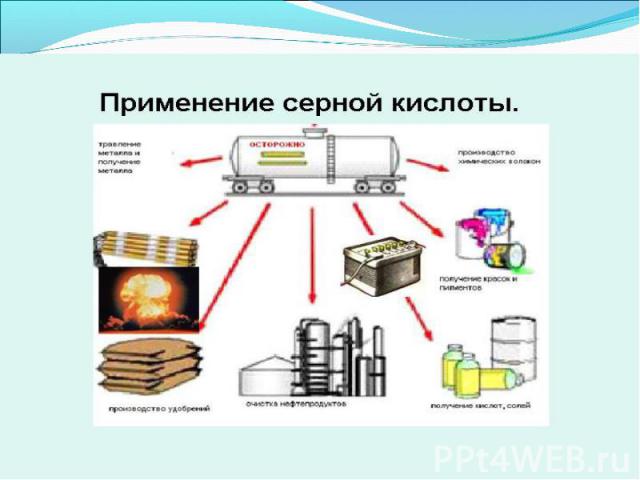
Цель работы: Узнать:из чего получают серную кислоту;как получают серную кислоту;для чего получают серную кислоту;вредно ли производство серной кислоты?

Серная кислота H2SO4 В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1, — раствор SO3 в серной кислоте. Раствор серного ангидрида в серной кислоте называют олеумом.
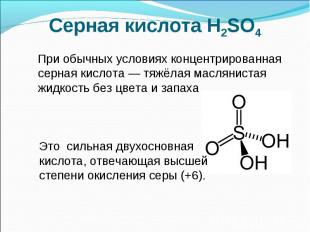
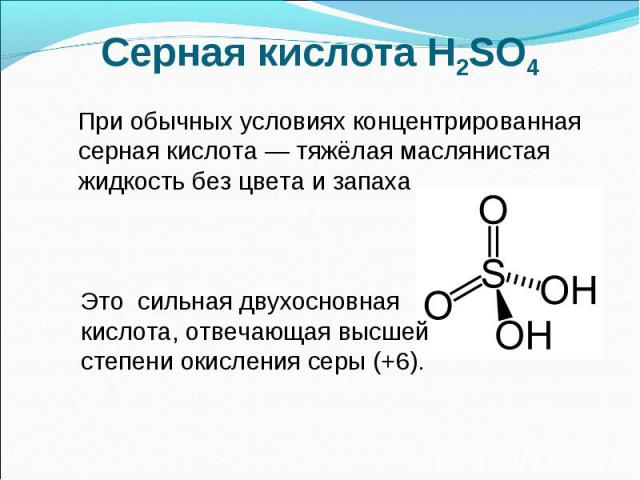
Серная кислота H2SO4 При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха Это сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).

Сырьё, используемое для производства серной кислоты:Самородная сера S Пирит (серный колчедан) FeS2 http://www.catalogmineralov.ru/article/98.html http://www.24open.ru/csucatudacha/blog/589875/Сероводород H2S

Сырьё, используемое для производства серной кислоты:Сульфиды цветных металловКристаллы сульфида цинка http://basik.ru/forum/index.php?showtopic=88Кристаллы сульфида медиhttp://www.terramarina.okis.ru/P_3.html

Производство серной кислоты.Серную кислоту в промышленности производят двумя способами: контактным и нитрозным. http://www.newchemistry.ru/letter.php?n_id=950

Производство серной кислоты.Основные стадии получения серной кислоты:Обжиг сырья с получением SO2Окисление SO2 в SO3АбсорбцияSO3В промышленности применяют два метода окисления SO2 : контактный — с использованием твердых катализаторов(контактов) и нитрозный — с оксидами азота.

Контактный способПодготовка сырья.Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Очистка пирита. После измельчения пирита, его очищают методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют.
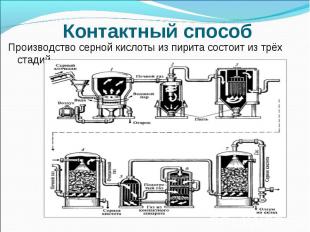
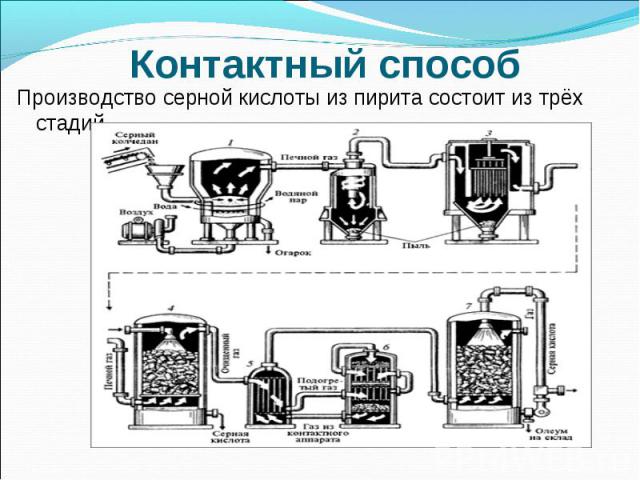
Контактный способПроизводство серной кислоты из пирита состоит из трёх стадий.

Контактный способПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое".Пирит сверху засыпают в печь. Снизу пропускают воздух, обогащённый кислородом. Температура в печи -800°С 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + QВыделяющейся теплотой :поддерживается температура в печи, а избытком отапливают рядом стоящие помещения.Оксид железа Fe2O3 (огарок) используют для получения железа и его сплавов на металлургических заводах . Принципы химического производства :безотходность производства., принцип противотока, принцип теплообмена

Контактный способ Очистку печного газа от твёрдых частичек огарка проводят в циклоне и в электрофильтрах . Для осушки печного газа используют серную концентрированную кислоту, (хорошо поглощает воду).

Контактный способВТОРАЯ СТАДИЯ - окисление SO2 в SO3 кислородом. 2SO2 + O2 2SO3 + QОптимальные условия реакции:температура 400-500°С (температура в контактном аппарате поддерживается за счёт теплоты в реакции превращения SO2 в SO3. ) Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. катализатор- оксид ванадия V2O5; повышенное давление.

Контактный способТРЕТЬЯ СТАДИЯ - поглощение SO3 серной кислотой. nSO3 + H2SO4 H2SO4·nSO3 Для того, чтобы не образовывалось сернокислотного тумана, используют 98%- ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3, который и перевозят по назначению по ж/д

Нитрозный способСо стадии окисления SO2 до H2SO4,.оба метода отличаются друг от друга.В специальной окислительной башне смешивают окись азота NO и NO2 своздухом2NO + O2 2NO2Смесь подаётся в башни орошаемые 75% - ной серной кислотой; здесь смесь окислов азота поглощается с образованием нитрозиллерной кислоты:NO + NO2 + 2H2SO4 2NO(HSO4) + H2OРаствор нитрозиллерной кислоты в серной кислоте, называемый нитрозой, орошает башни , куда противотоком поступает SO2 ,и добавляется вода.В результате гидролиза нитрозиллерной кислоты образуется азотная кислота:NO(HSO4) + H2OH2SO4 + HNO2Она - то и окисляет SO2 по уравнению:SO2 + 2HNO2H2SO4 + 2NO

Нитрозный способНедостаток нитрозного метода :серная кислота имеет концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз нитрозиллерной кислоты).;башенная серная кислота бывает недостаточно чистой, что ограничивает её применение.Преимущество нитрозного метода : примеси ,содержащиеся в SO2, не влияют на ход процесса, так что исходный SO2 достаточно очистить от пыли.

Вред производства серной кислоты. В зоне до 300 км от источника загрязнения (SO2) опасность представляет серная кислота, в зоне до 600 км. - сульфаты.

Вред производства серной кислоты.Серная кислота и сульфаты приводят:к замедлению роста с/х культур; к закислению водоемов (влечёт гибель икр и молоди рыб);к разрушению конструкций из известняка и мрамора; повышение коррозионного износа металлов; увеличение количества случаев респираторных заболеваний человека и животных; громадные суммы каждый год теряются при раскислении почв.

Информационные ресурсыhttp://ru.wikipedia.org/http://www.alhimikov.net/http://referat.resurs.kz/