Презентация на тему: Особенности строения органических соединений

Особенности строения соединений органической химии. Учитель МОБУ СШО ЛГО с. Пантелеймоновка Яценко Г.П. Органическая химия 10 класс.

Органическая химия. Классическое определение науки органической химии дал немецкий химик К.Шорлеммер более 150 лет назад. «Органическая химия есть химия углеводородов и их производных, т.е. продуктов, образующихся при замене водорода другими атомами или группами атомов». К.Шорлеммер Карл Шорлеммер (30.09.1834-27.06.1892)
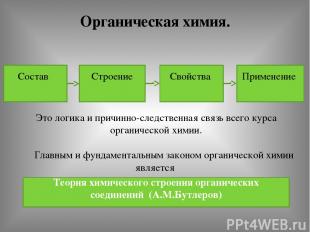
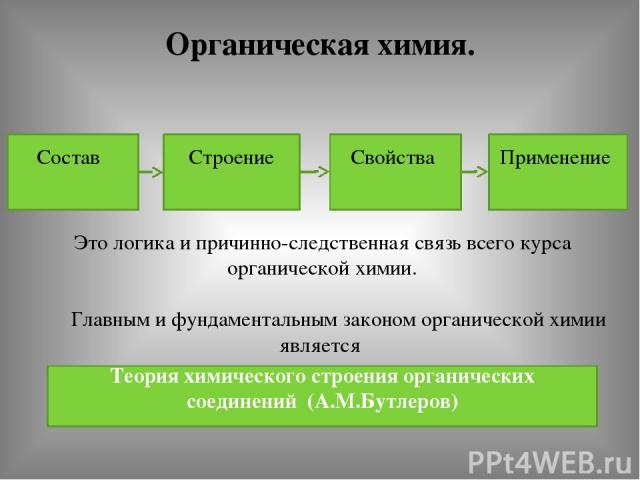
Органическая химия. Состав Строение Свойства Применение Это логика и причинно-следственная связь всего курса органической химии. Главным и фундаментальным законом органической химии является Теория химического строения органических соединений (А.М.Бутлеров)

Органическая химия. На сегодняшний день органическая химия – один из самых крупных и важных разделов химии. Число известных органических соединений увеличивается в геометрической прогрессии – превышает 18 млн. Большинство современных промышленных процессов в химической индустрии – получение органических веществ или процессов с их участием (основной и тонкий органический синтез). Большинство процессов, протекающих в живых организмах и обеспечивающих их существование, - это реакции органических веществ.(Органическая химия – это химия жизни). На основе достижений органической химии работают биотехнология и генная инженерия.

Особенности строения соединений углерода. Специфика органических соединений: Углерод – единственный элемент ПСХЭ, атомы которого способны образовывать очень длинные цепочки, соединяясь друг с другом. Наиболее важными считаются соединения углерода и водорода (углеводороды), остальные классы органических веществ – их производные.

Электронное строение атома углерода. Теория строения органического вещества позволяет сделать вывод относительно углерода в связи с его положением в периодической системе: 1.Углерод четырехвалентен. 2. Все валентности атома углерода равнозначны и размещены симметрично. 3. Углерод способен соединяться как с металлами, так и с неметаллами. 4. Атомы углерода, соединяясь друг с другом, могут образовывать цепи, тратя на связь по одной, две или три единицы валентности. СаС2; СН4
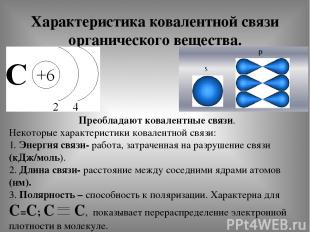
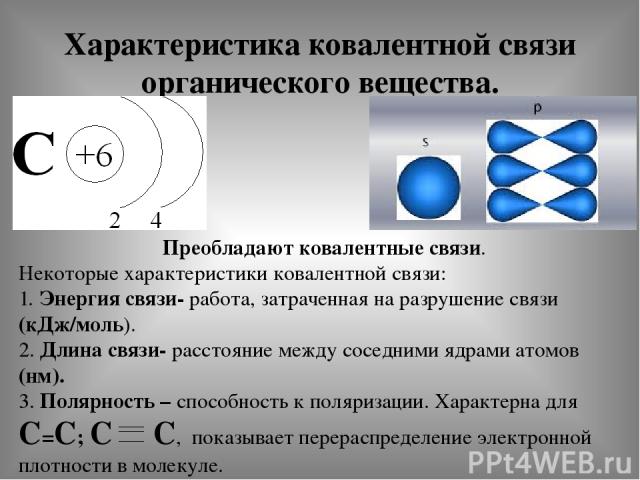
Характеристика ковалентной связи органического вещества. Преобладают ковалентные связи. Некоторые характеристики ковалентной связи: 1. Энергия связи- работа, затраченная на разрушение связи (кДж/моль). 2. Длина связи- расстояние между соседними ядрами атомов (нм). 3. Полярность – способность к поляризации. Характерна для С=С; С С, показывает перераспределение электронной плотности в молекуле.
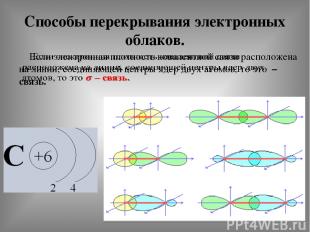
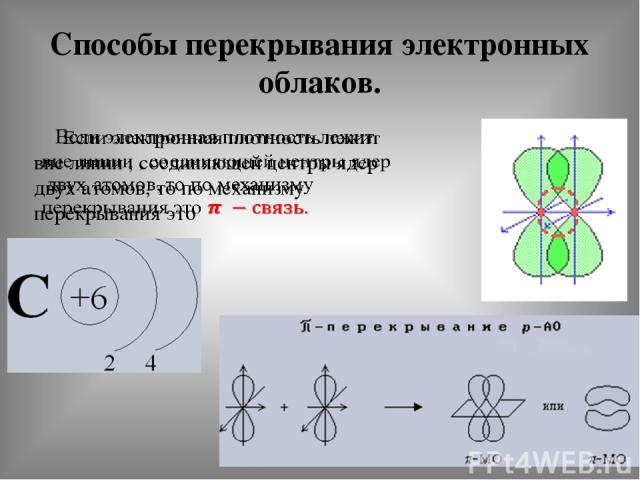
Способы перекрывания электронных облаков.
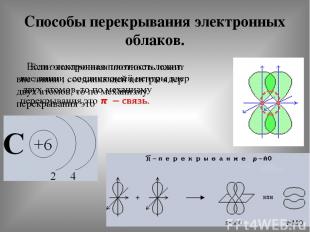
Способы перекрывания электронных облаков.
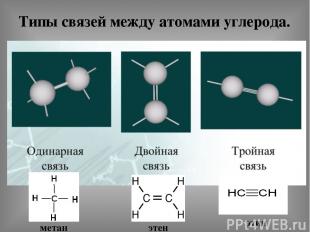
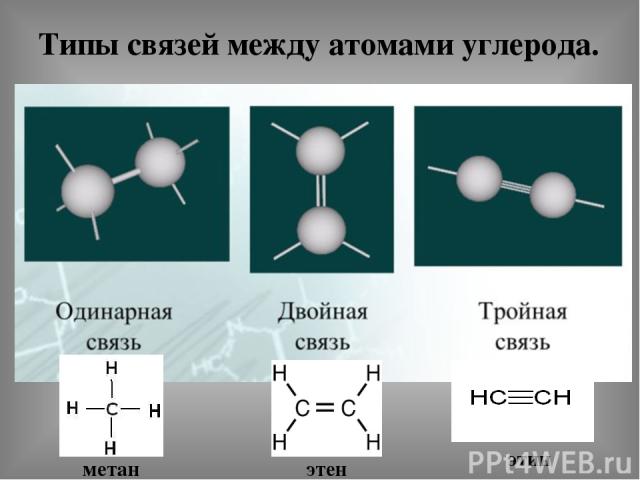
Типы связей между атомами углерода. метан этен этин

Способы разрыва ковалентной связи. Гомолитический (симметричный) – разрыв связи, при котором каждый атом получает по одному электрону из общей пары. Ковалентная связь ИТОГ: две частицы – радикалы (R). Гетеролитический (ассимметричный или ионный) – разрыв связи, при котором общая электронная пара остается у одного атома. ИТОГ: две заряженные частицы – катион (карбокатион) и анион (карбоанион). А : В А· + ·В А : В А+ + :В ионы радикалы

Гибридизация атома углерода. Лайнус Карл Полинг (28.02.1901- 19.08.1994) Американский ученый. Первым успешно предсказал вторичную структуру белка. В 1954 году «за исследования природы химической связи и её применения для определения структуры соединений» был удостоен Нобелевской премии. Негибридизованные облака гибридные облака
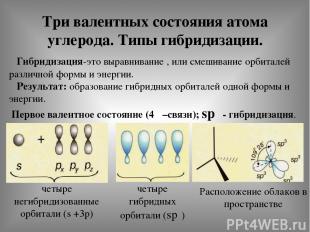
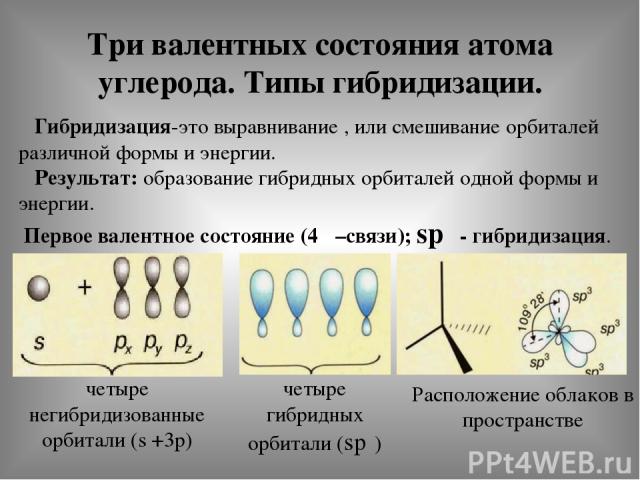
Три валентных состояния атома углерода. Типы гибридизации. Гибридизация-это выравнивание , или смешивание орбиталей различной формы и энергии. Результат: образование гибридных орбиталей одной формы и энергии. Первое валентное состояние (4δ –связи); spᶟ - гибридизация. четыре негибридизованные орбитали (s +3р) четыре гибридных орбитали (spᶟ) Расположение облаков в пространстве
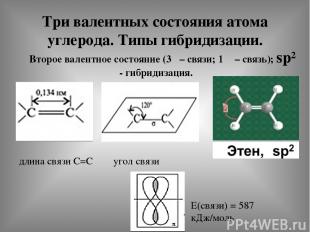
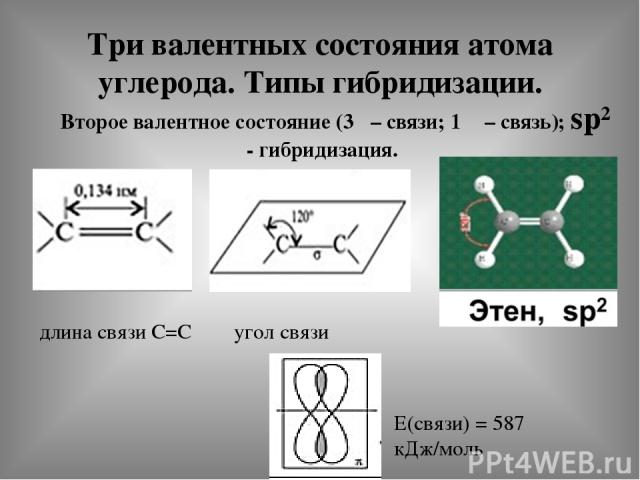
Три валентных состояния атома углерода. Типы гибридизации. Второе валентное состояние (3δ – связи; 1 π – связь); sp² - гибридизация. длина связи С=С угол связи Е(связи) = 587 кДж/моль

Три валентных состояния атома углерода. Типы гибридизации. Третье валентное состояние (2δ – связи; 2π – связи); sp - гибридизация. длина связи С С угол связи = 180° Е(связи) = 839 кДж/моль
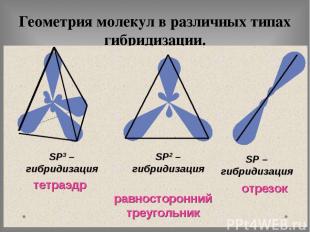
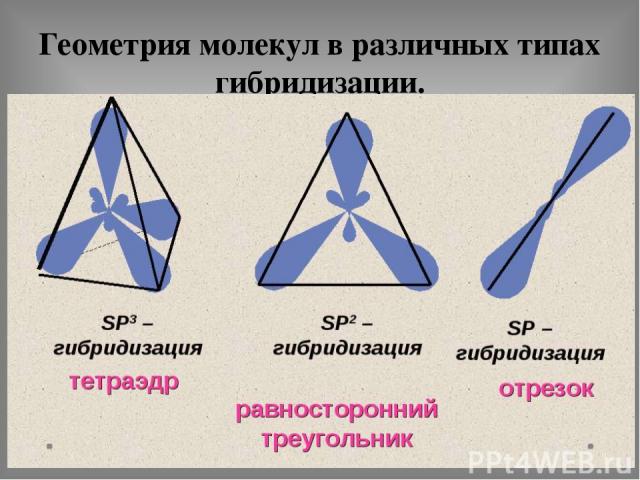
Геометрия молекул в различных типах гибридизации.
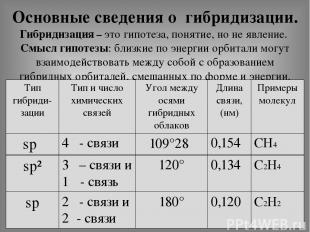
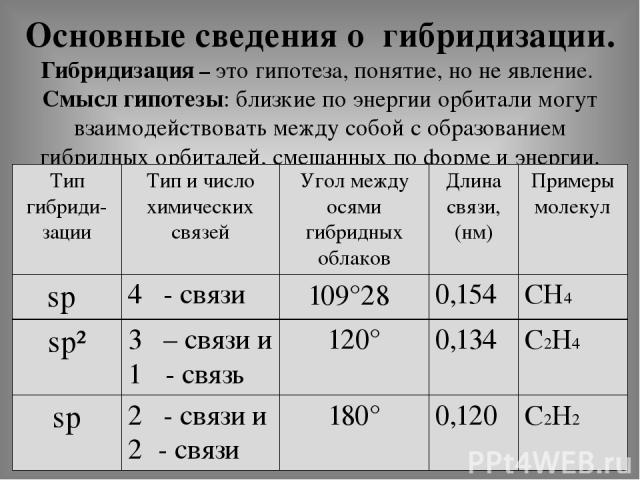
Основные сведения о гибридизации. Гибридизация – это гипотеза, понятие, но не явление. Смысл гипотезы: близкие по энергии орбитали могут взаимодействовать между собой с образованием гибридных орбиталей, смешанных по форме и энергии. Тип гибриди- зации Тип и число химических связей Угол между осями гибридных облаков Длина связи, (нм) Примеры молекул spᶟ 4δ- связи 109°28׳ 0,154 СН4 sp² 3δ– связи и 1π- связь 120° 0,134 С2Н4 sp 2δ- связи и 2π- связи 180° 0,120 С2Н2
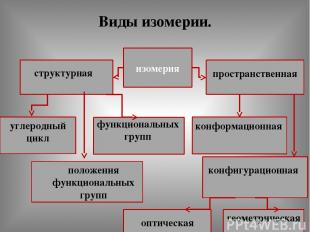
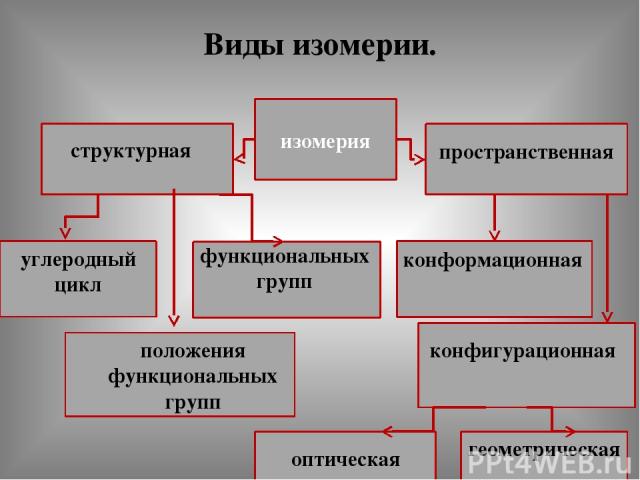
Виды изомерии. изомерия структурная пространственная углеродный цикл функциональных групп положения функциональных групп конфигурационная оптическая геометрическая конформационная
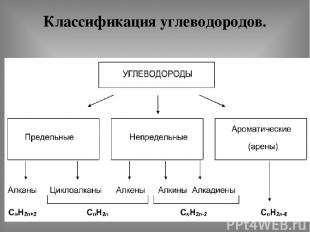
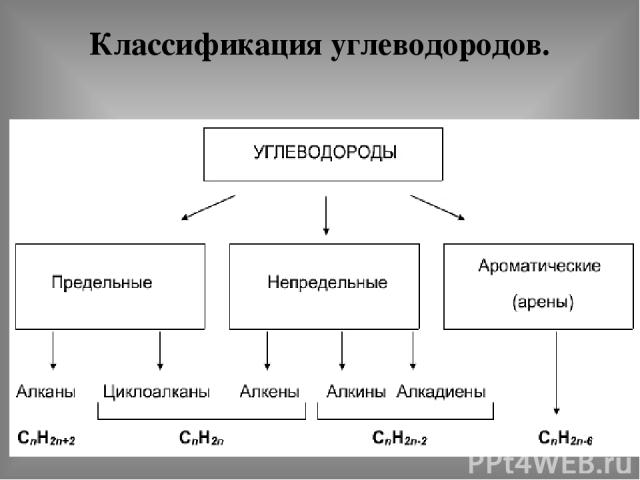
Классификация углеводородов.
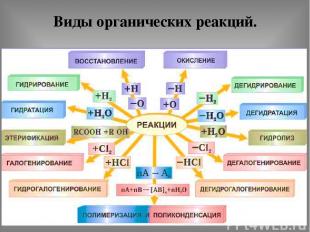
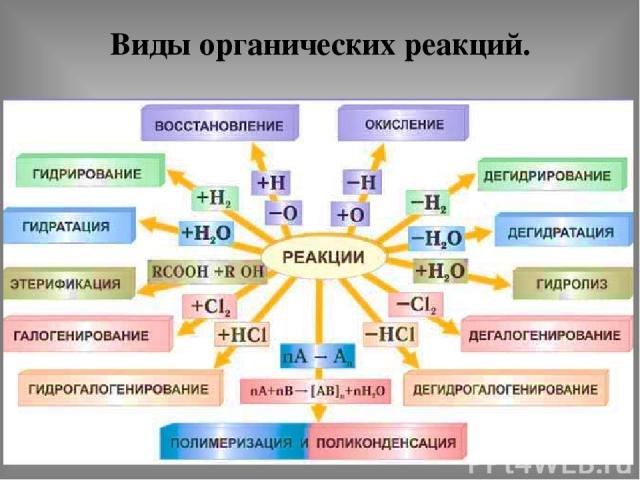
Виды органических реакций.

Материалы оформления. http://www.krugosvet.ru/images/1007997_7997_201.jpghttps://encrypted-tbn1.gstatic.com/images?q=tbn:ANd9GcRxPPdCNFhKZpEPVyVddAeObrwKwmdHQj3JbjLTdOUlcK5B0wnO https://encryptedtbn0.gstatic.com/images?q=tbn:ANd9GcTV5RpPCztLt7c1gBssckWWUZua7QPNtVdrqNKxAhob9C6ErfGT https://encryptedtbn1.gstatic.com/images?q=tbn:ANd9GcQjJLSde9ExFPAAU0R76Dp31sP08iW6gUJkg73HNuYJDM4gMeg http://900igr.net/datai/khimija/Aromaticheskie-uglevodorody/0004-006-Svojstva.jpg http://3.bp.blogspot.com/LBCwnW7T50M/T4U86s1HkJI/AAAAAAAABMM/e_Y_kqznjN4/s320/Organ_Chem_1.jpg http://1.bp.blogspot.com/ardFCz_N55k/VD5yju24wMI/AAAAAAAAD8s/7_gBEOZlsXE/s1600/%D0%B3%D0%B8%D0%B1%D1%80%D0%B8%D0%B4%D0%B8%D0%B7%D0%B0%D1%86%D0%B8%D1%8F.jpg http://bigslide.ru/images/1/625/960/img6.jpg http://ecentr.com.ua/wpcontent/uploads/2012/03/%D0%B8%D0%BF%D0%BF%D0%B0%D1%80%D0%B0%D1%80.jpg http://artifuckt.ru/wp-content/uploads/2012/06/4Reakcii2.jpg http://artifuckt.ru/wp-content/uploads/2012/06/4Reakcii2.jpg http://www.chemistry.ssu.samara.ru/chem1/pic/pic4_2_3_1.gif http://images.myshared.ru/411026/slide_12.jpg http://images.myshared.ru/201770/slide_9.jpg

Информация для педагога. ЦОр предназначен для обучения учащихся 10 класса общеобразовательной школы. Материал может быть использован на уроке – обобщении как целый продукт; на уроках ознакомления с новым материалом и понятиями – фрагментарно; при передаче на флэш носители учащихся - для самоподготовки к ЕГЭ, к проверочной работе по теме «Особенности строения органических веществ». В предлагаемом ресурсе прослеживается логика ознакомления учащихся с особенностями соединений органической химии. Использование схем облегчает восприятие достаточно сложного материала. Презентация рассчитана на использование УМК О.С.Габриеляна (базовый уровень).