Презентация на тему: Периодическая система химических элементов Д.И. Менделеева и строение атома

Периодическая система Д.И. Менделеева и строение атома Обязательный минимум знаний при подготовке к ОГЭ по химии Автор: Кулаева Галина Николаевна, учитель химии МБОУ СОШ с. Троицкого Моздокского района РСО - Алания

Цель: Повторить основные теоретические вопросы программы 8 класса; Закрепить знания о причинах изменения свойств химических элементов на основании положения в ПСХЭ Д.И. Менделеева; Научить обоснованно объяснять и сравнивать свойства элементов, а также образованных ими простых и сложных веществ по положению в ПСХЭ; Подготовить к успешной сдаче ОГЭ по химии
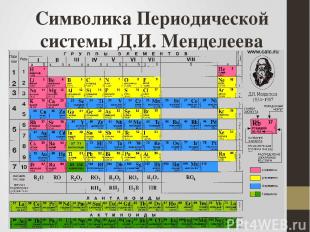
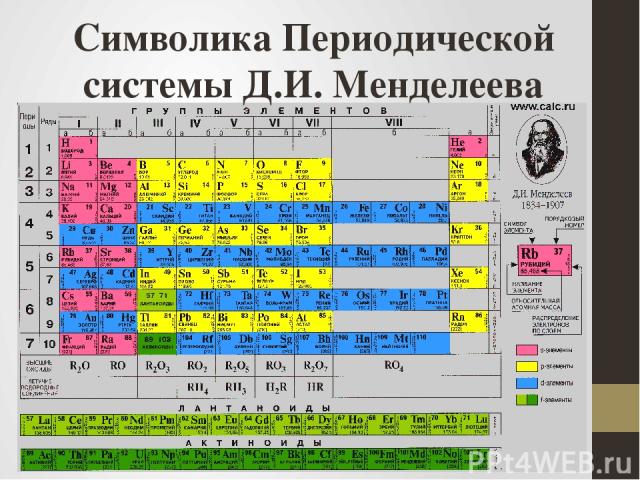
Символика Периодической системы Д.И. Менделеева
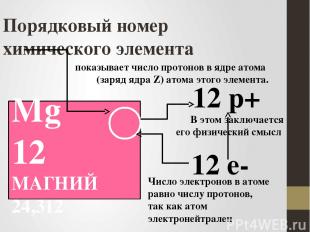
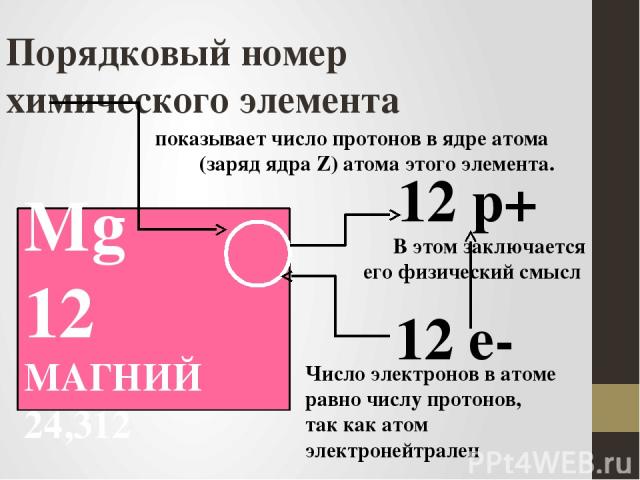
Порядковый номер химического элемента Mg 12 МАГНИЙ 24,312 12 р+ 12 е- показывает число протонов в ядре атома (заряд ядра Z) атома этого элемента. В этом заключается его физический смысл Число электронов в атоме равно числу протонов, так как атом электронейтрален

Закрепим! Са 20 КАЛЬЦИЙ 40,08 Z = +20 20 р+ 20 е- S S 32 СЕРА 32,064 Z = +32 32 р+ 32е-

Закрепим! Zn 30 ЦИНК 65,37 Z = +30 30 р+ 30 е- S Br 35 БРОМ 79,904 Z = +35 35 р+ 35е-
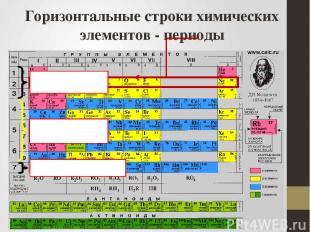
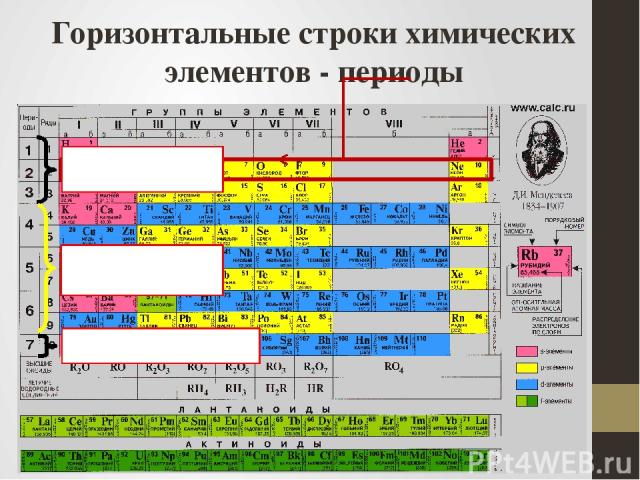
Горизонтальные строки химических элементов - периоды малые большие незавершенный
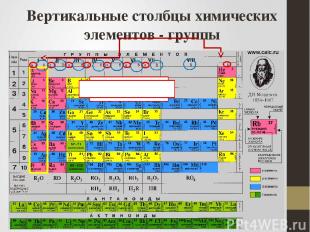
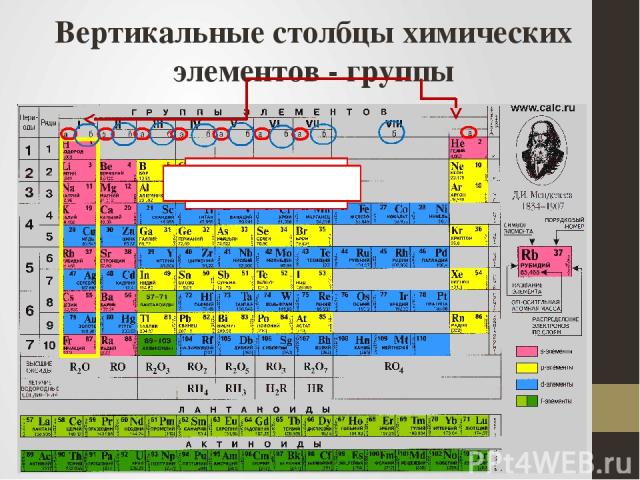
Вертикальные столбцы химических элементов - группы главные побочные

Пример записи схемы строения атома химического элемента 11Na 23 +11 Число электронных слоев в электронной оболочке атома равно номеру периода, в котором расположен элемент Натрий: порядковый номер 11 (записывается в нижнем левом углу рядом с символом химического элемента) Относительная атомная масса (округленное до целого числа значение) записывается в верхнем левом углу над порядковым номером 11р+ 11е- Количество нейтронов вычисляется по формуле: N(n0) = Ar – N(p+) - 12 n0 Заряд ядра атома (Z) натрия Число электронов на внешнем уровне для элементов главных подгрупп равно номеру группы, в которой расположен элемент 1 Максимальное число электронов на уровне вычисляется по формуле: 2n2 2∙12 2 2∙ 22 8

Закрепим! 13Al 27 +13 13р+ 13е- - 14 n0 Заряд ядра атома (Z) алюминия 3 2∙12 2 2∙ 22 8

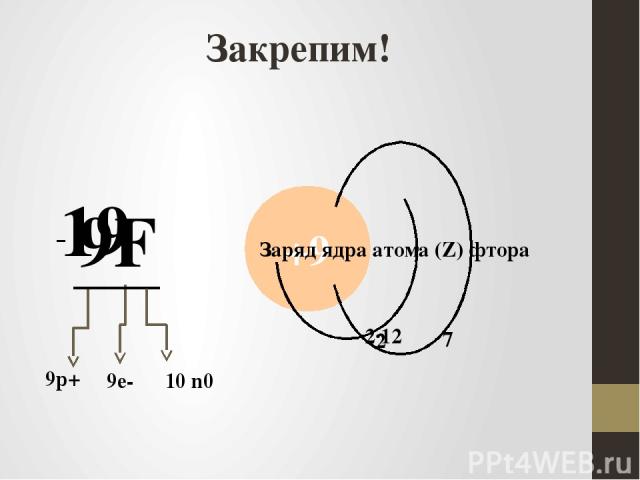
Закрепим! 9F 19 +9 9р+ 9е- - 10 n0 Заряд ядра атома (Z) фтора 7 2∙12 2

Закономерности изменения свойств элементов и их соединений

В пределах одного периода 1. Возрастают: I II III IV V VI VII VIII Li Be B C N O F Ne +3 +4 +5 +6 +7 +8 +9 +10 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 Заряд атомного ядра Число электронов во внешнем слое атомов Высшая степень окисления элементов в соединениях Li+1 Be+2 B+3 C+4 N+5 Электроотрицательность Окислительные свойства Неметаллические свойства простых веществ Кислотные свойства высших оксидов и гидроксидов

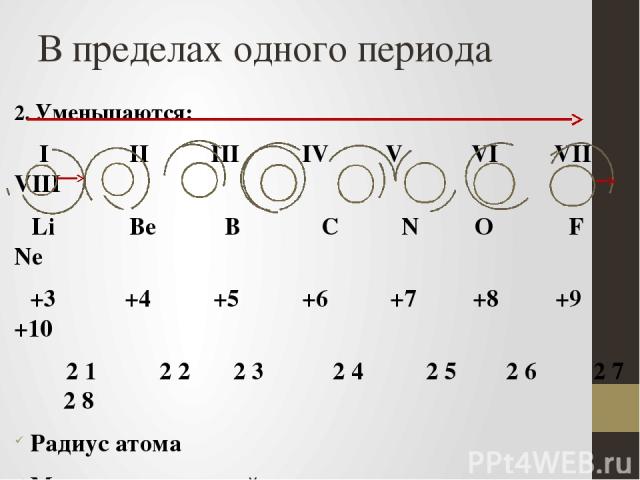
В пределах одного периода 2. Уменьшаются: I II III IV V VI VII VIII Li Be B C N O F Ne +3 +4 +5 +6 +7 +8 +9 +10 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 Радиус атома Металлические свойства простых веществ Восстановительные свойства: Li - только восстановитель, С – и окислитель, и восстановитель, F – только окислитель Основные свойства высших оксидов и гидроксидов: LiOH – основание,Be(OH)2 – амфотерный гидроксид, HNO3 - кислота

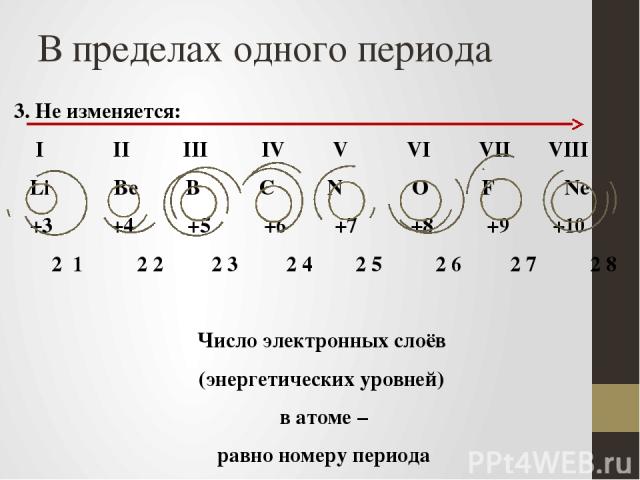
В пределах одного периода 3. Не изменяется: I II III IV V VI VII VIII Li Be B C N O F Ne +3 +4 +5 +6 +7 +8 +9 +10 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 Число электронных слоёв (энергетических уровней) в атоме – равно номеру периода

Закрепим! В периодах слева направо заряд ядра атома Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается

Закрепим! В периодах справа налево число энергетических уровней Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается

Закрепим! В периодах слева направо восстановительные свойства элемента Усиливаются Ослабевают Не изменяются Сначала ослабевают, а затем усиливаются

Закрепим! Атомы химических элементов алюминия и кремния имеют одинаковое: Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Число электронов

Закрепим! Атомы химических элементов серы и хлора имеют различное: Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов
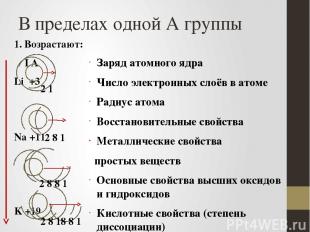
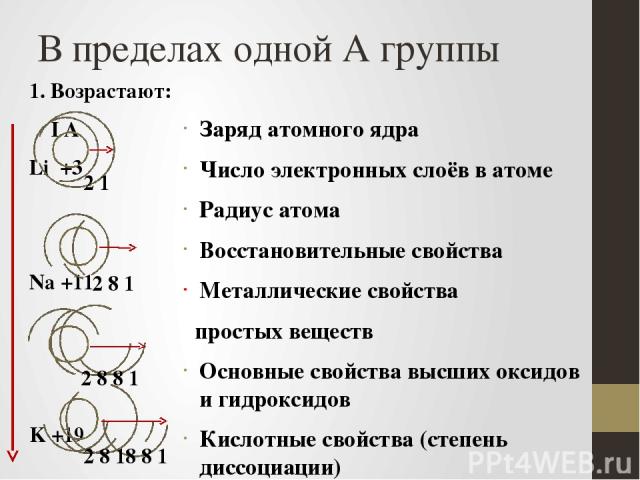
В пределах одной А группы 1. Возрастают: I А Li +3 Na +11 K +19 Rb +37 Заряд атомного ядра Число электронных слоёв в атоме Радиус атома Восстановительные свойства Металлические свойства простых веществ Основные свойства высших оксидов и гидроксидов Кислотные свойства (степень диссоциации) бескислородных кислот неметаллов 2 8 1 2 1 2 8 8 1 2 8 18 8 1
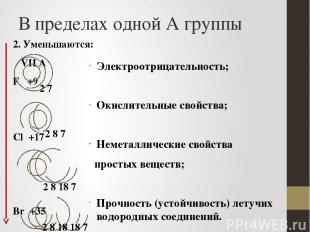
В пределах одной А группы 2. Уменьшаются: VII А F +9 Cl +17 Br +35 I +53 Электроотрицательность; Окислительные свойства; Неметаллические свойства простых веществ; Прочность (устойчивость) летучих водородных соединений. 2 8 7 2 7 2 8 18 7 2 8 18 18 7
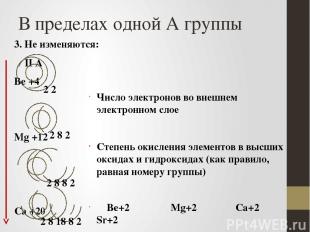
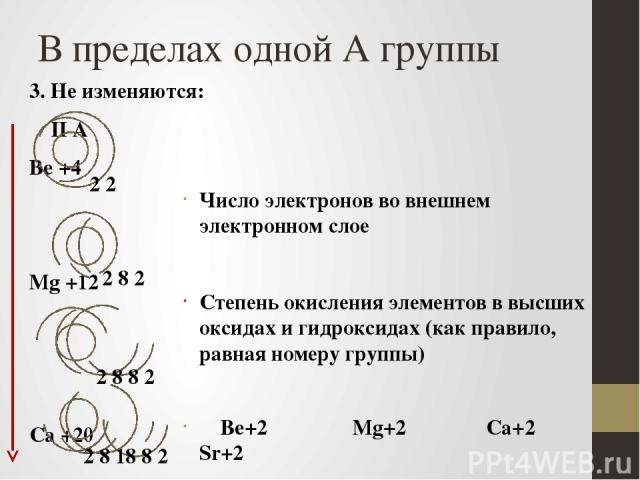
В пределах одной А группы 3. Не изменяются: II А Be +4 Mg +12 Ca +20 Sr +38 Число электронов во внешнем электронном слое Степень окисления элементов в высших оксидах и гидроксидах (как правило, равная номеру группы) Be+2 Mg+2 Ca+2 Sr+2 2 8 2 2 2 2 8 8 2 2 8 18 8 2

Закрепим! В главных подгруппах снизу вверх заряд ядра атома Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается

Закрепим! В главных подгруппах снизу вверх число электронов на внешнем уровне Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается

Закрепим! В главных подгруппах снизу вверх окислительные свойства элемента Усиливаются Ослабевают Не изменяется Сначала увеличивается, а затем уменьшается

Закрепим! Атомы химических элементов углерода и кремния имеют одинаковое: Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов в атоме

Закрепим! Атомы химических элементов азота и фосфора имеют различное: Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов

Домашнее задание: § 36, тест стр. 268-272

Спасибо за активную работу!

Список литературы Таблица Д.И. Менделеева http://s00.yaplakal.com/pics/pics_original/7/7/0/2275077.gif Габриелян О.С. «Химия. 9 класс», - ДРОФА, М., - 2013, с. 267-268 Савельев А.Е. Основные понятия и законы химии. Химические реакции. 8 – 9 классы. – М.: ДРОФА, 2008, - с. 6-48. Рябов М.А., Невская Е.Ю. «Тесты по химии» к учебнику О.С. Габриеляна «Химия. 9 класс». – М.: ЭКЗАМЕН, 2010, с. 5-7