Презентация на тему: Строение атома и периодическая система химических элементов

Строение атома и периодическая система химических элементов (продолжение)
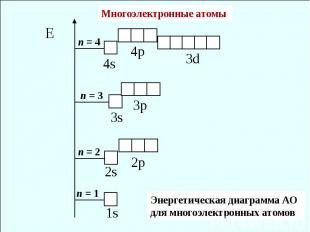
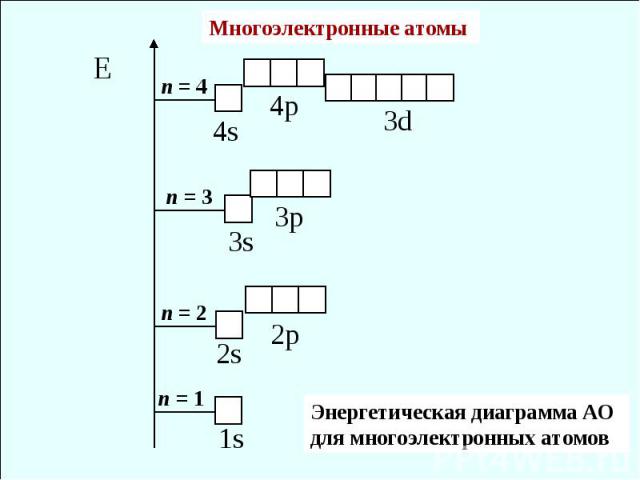
Многоэлектронные атомы Энергетическая диаграмма АО для многоэлектронных атомов
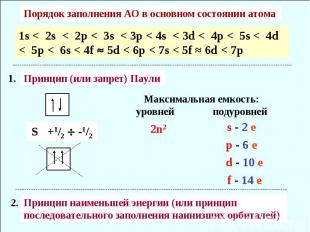
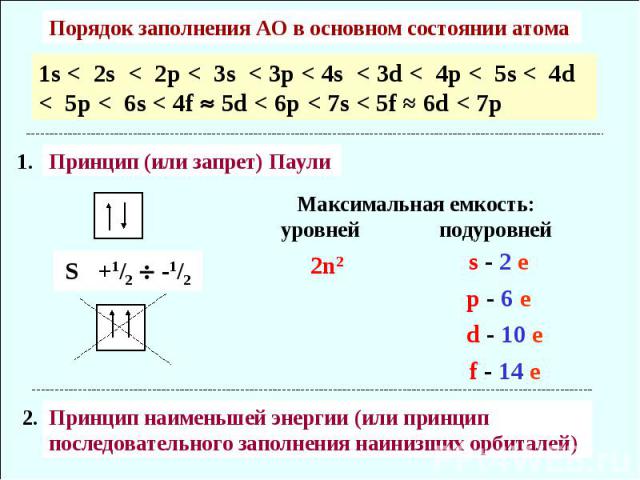
Порядок заполнения АО в основном состоянии атома 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f 5d < 6p < 7s < 5f ≈ 6d < 7p Принцип (или запрет) Паули Максимальная емкость: уровней подуровней Принцип наименьшей энергии (или принцип последовательного заполнения наинизших орбиталей)

Правило Хунда При данном значении l (т.е. в пределах одного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным Суммарный спин электронов

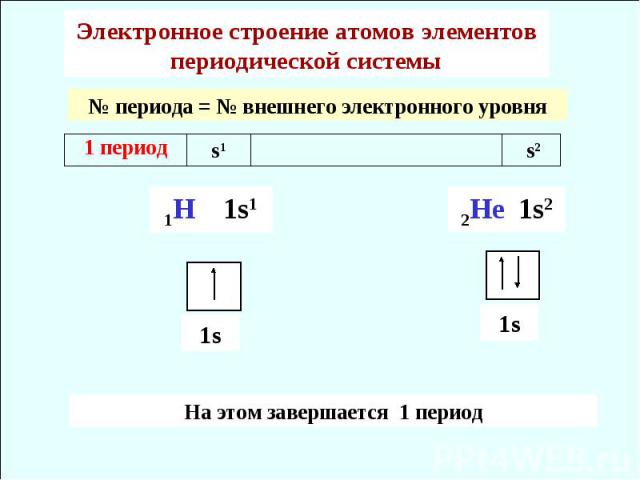
Электронное строение атомов элементов периодической системы № периода = № внешнего электронного уровня На этом завершается 1 период
![2ой период3Li 1s22s1 [He]2s1 4Be 1s22s2 2ой период3Li 1s22s1 [He]2s1 4Be 1s22s2](https://fs1.ppt4web.ru/images/2966/52295/310/img5.jpg)
2ой период3Li 1s22s1 [He]2s1 4Be 1s22s2
![5В 1s22s22p1 [He]2s22p1 6C 1s22s22p2 [He]2s22p2 Противоречит правилу Хунда 5В 1s22s22p1 [He]2s22p1 6C 1s22s22p2 [He]2s22p2 Противоречит правилу Хунда](https://fs1.ppt4web.ru/images/2966/52295/310/img6.jpg)
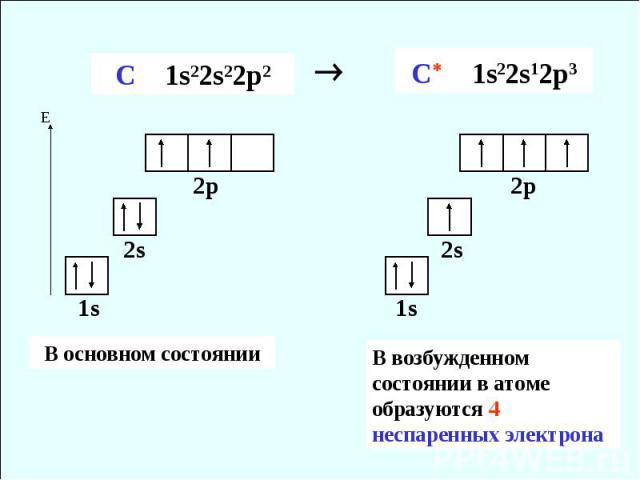
5В 1s22s22p1 [He]2s22p1 6C 1s22s22p2 [He]2s22p2 Противоречит правилу Хунда
![7N 1s22s22p3 [He]2s22p3 8O 1s22s22p4 [He]2s224 7N 1s22s22p3 [He]2s22p3 8O 1s22s22p4 [He]2s224](https://fs1.ppt4web.ru/images/2966/52295/310/img7.jpg)
7N 1s22s22p3 [He]2s22p3 8O 1s22s22p4 [He]2s224
![9F 1s22s22p5 [He]2s22p510Ne 1s22s22p6 [He]2s22p6 = [Ne] 9F 1s22s22p5 [He]2s22p510Ne 1s22s22p6 [He]2s22p6 = [Ne]](https://fs1.ppt4web.ru/images/2966/52295/310/img8.jpg)
9F 1s22s22p5 [He]2s22p510Ne 1s22s22p6 [He]2s22p6 = [Ne]
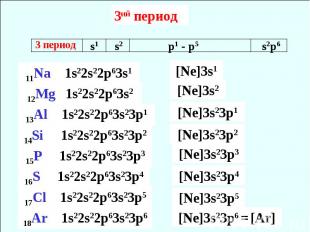
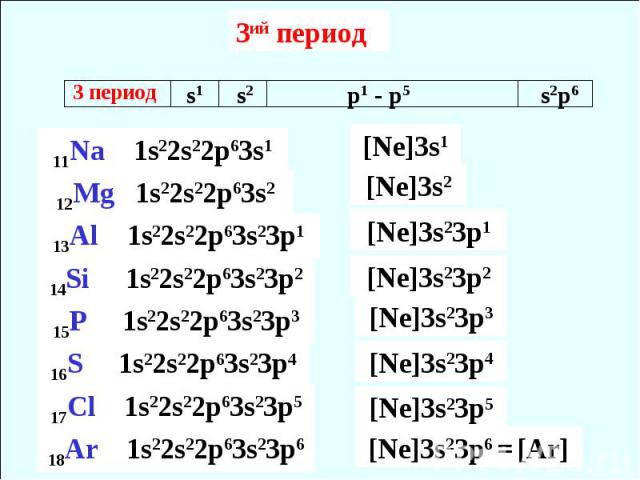
3ий период
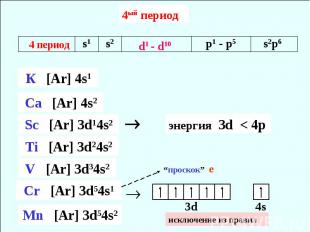
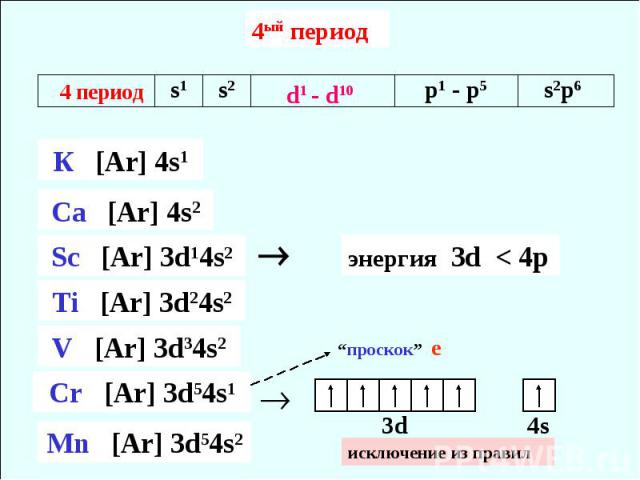
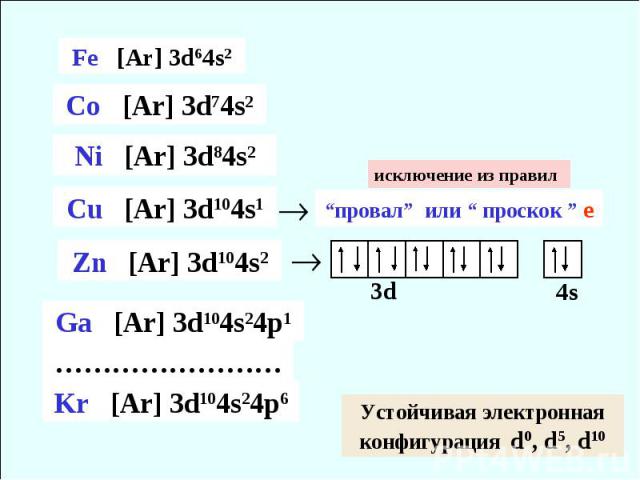
4ый период исключение из правил
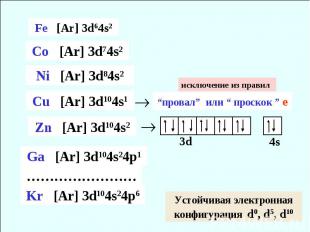
исключение из правил “провал” или “ проскок ” е Устойчивая электронная конфигурация d0, d5, d10
![исключения из правил Ag, Nb, Mo, Ru, Rh, Pd Pd [Kr] 4d105s0 Au [Xe] 5d106s1 Pt [ исключения из правил Ag, Nb, Mo, Ru, Rh, Pd Pd [Kr] 4d105s0 Au [Xe] 5d106s1 Pt [](https://fs1.ppt4web.ru/images/2966/52295/310/img12.jpg)
исключения из правил Ag, Nb, Mo, Ru, Rh, Pd Pd [Kr] 4d105s0 Au [Xe] 5d106s1 Pt [Xe] 5d96s1
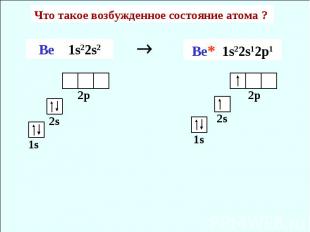
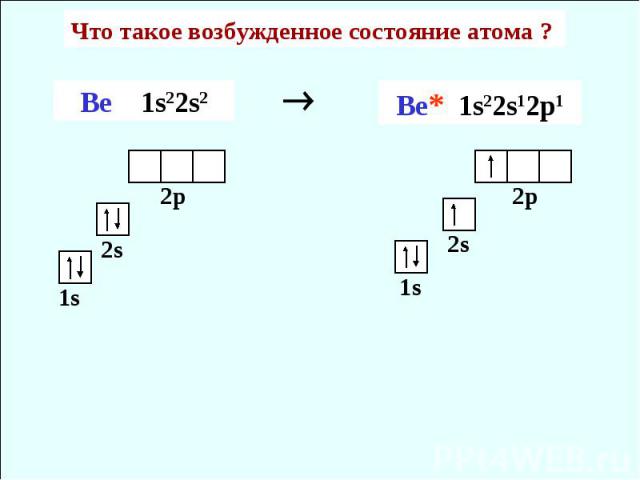
Что такое возбужденное состояние атома ? Ве 1s22s2 Be* 1s22s12p1
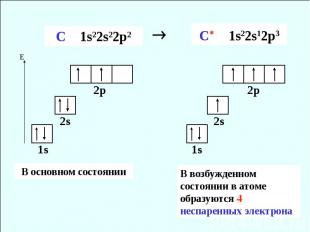
В возбужденном состоянии в атоме образуются 4 неспаренных электрона
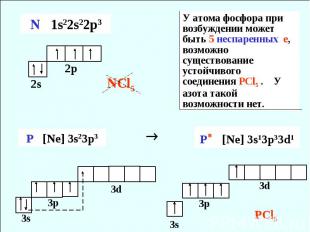
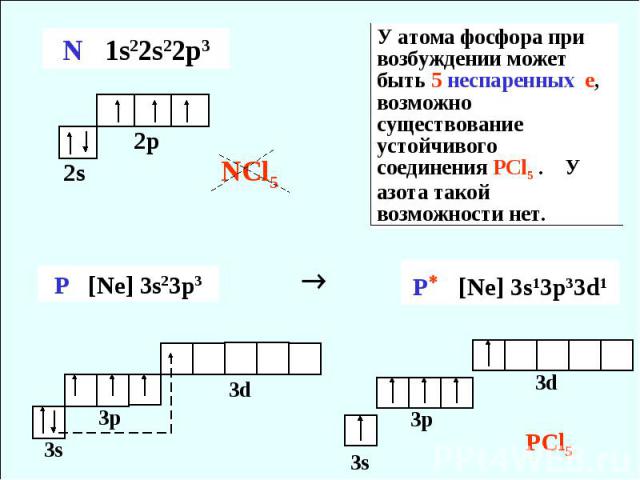
У атома фосфора при возбуждении может быть 5 неспаренных е, возможно существование устойчивого соединения PCl5 . У азота такой возможности нет.

Парамагнитные и диамагнитные свойства веществ Диамагнитные свойства Парамагнитные свойства

1. По горизонтали – периоды. Всего 7 периодов.2. По вертикали – группы. Всего 8 групп.3. Группы делятся на подгруппы ( А и В ): А - подгруппы – главные В - подгруппы – побочные4. В А-подгруппах находятся s- и p-элементы В В-подгруппах находятся d- и f- элементы

Характеристика семейств элементов
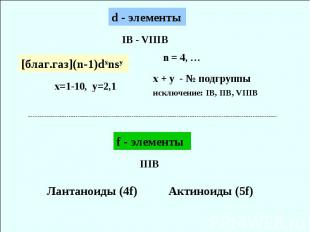
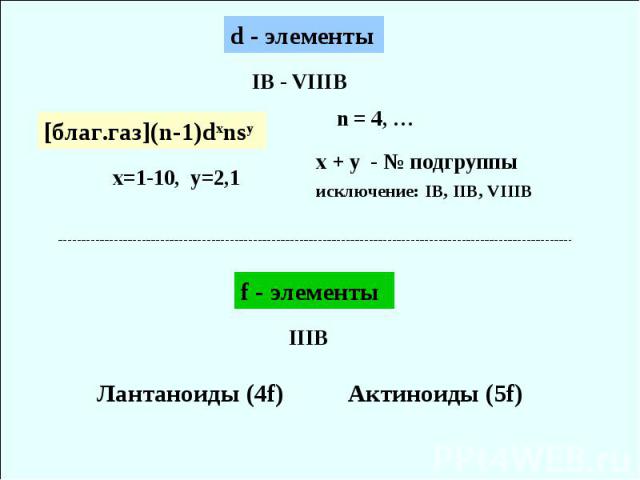
IB - VIIIB x=1-10, y=2,1 х + y - № подгруппы исключение: IB, IIB, VIIIB Лантаноиды (4f) Актиноиды (5f)
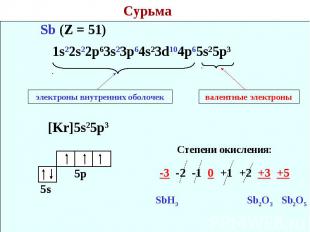
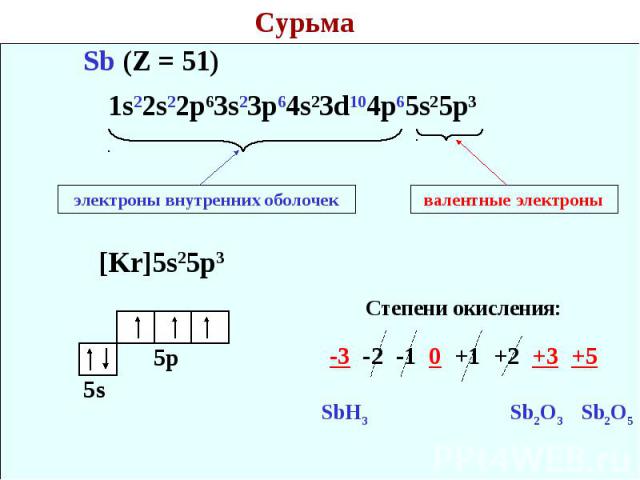
Сурьма 1s22s22p63s23p64s23d104p65s25p3 электроны внутренних оболочек валентные электроны Степени окисления: -3 -2 -1 0 +1 +2 +3 +5
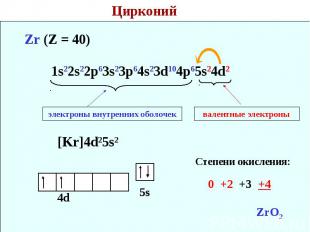
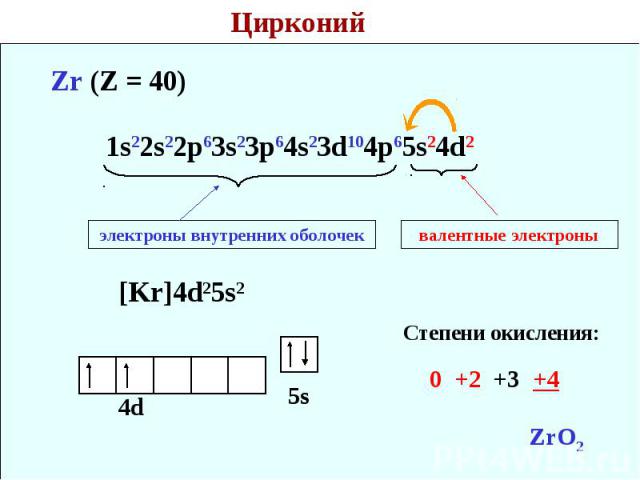
Цирконий Zr (Z = 40) 1s22s22p63s23p64s23d104p65s24d2 электроны внутренних оболочек валентные электроны

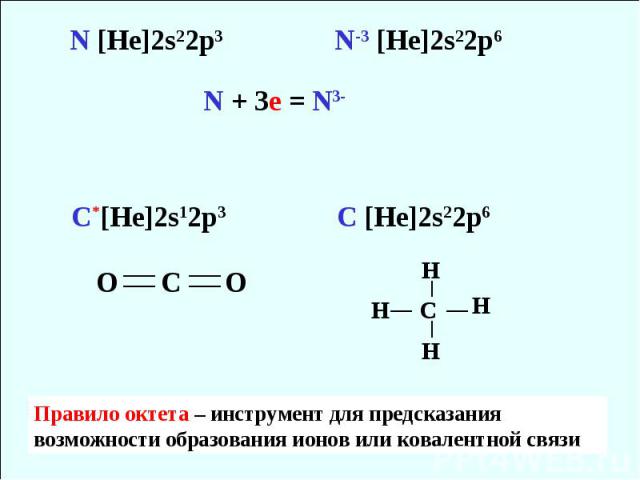
Правило октета На орбитали с n = 3 на s и p подуровнях число е = 8 (3s23p6 ) Атомы s- и p- элементов имеют тенденцию отдавать, принимать или объединять электроны так, чтобы заполнить восьмью электронами внешнюю оболочку
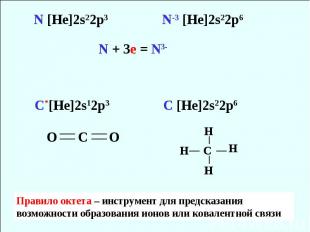
Правило октета – инструмент для предсказания возможности образования ионов или ковалентной связи

Периодический закон и Периодическая система химических элементов Д.И.Менделеева Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома (или порядкового номера элемента)



![2ой период3Li 1s22s1 [He]2s1 4Be 1s22s2 2ой период3Li 1s22s1 [He]2s1 4Be 1s22s2](https://fs1.ppt4web.ru/images/2966/52295/640/img5.jpg)
![5В 1s22s22p1 [He]2s22p1 6C 1s22s22p2 [He]2s22p2 Противоречит правилу Хунда 5В 1s22s22p1 [He]2s22p1 6C 1s22s22p2 [He]2s22p2 Противоречит правилу Хунда](https://fs1.ppt4web.ru/images/2966/52295/640/img6.jpg)
![7N 1s22s22p3 [He]2s22p3 8O 1s22s22p4 [He]2s224 7N 1s22s22p3 [He]2s22p3 8O 1s22s22p4 [He]2s224](https://fs1.ppt4web.ru/images/2966/52295/640/img7.jpg)
![9F 1s22s22p5 [He]2s22p510Ne 1s22s22p6 [He]2s22p6 = [Ne] 9F 1s22s22p5 [He]2s22p510Ne 1s22s22p6 [He]2s22p6 = [Ne]](https://fs1.ppt4web.ru/images/2966/52295/640/img8.jpg)
![исключения из правил Ag, Nb, Mo, Ru, Rh, Pd Pd [Kr] 4d105s0 Au [Xe] 5d106s1 Pt [Xe] 5d96s1 исключения из правил Ag, Nb, Mo, Ru, Rh, Pd Pd [Kr] 4d105s0 Au [Xe] 5d106s1 Pt [Xe] 5d96s1](https://fs1.ppt4web.ru/images/2966/52295/640/img12.jpg)