Презентация на тему: Кристаллы (10 класс)

Проект на тему:«Кристаллы» Работу выполнила: Канушкина Марина-ученица 10-б классаКоординатор:Жилина Мария Николаевна- учитель химии

Актуальность Природные кристаллы всегда возбуждали любопытство у людей. Их цвет, блеск и форма затрагивали человеческое чувство прекрасного, и люди украшали ими себя и свое окружение.

Цель Изучить химические составляющие кристаллов, их свойства, а так же узнать, какие кристаллы растут сами по себе в природе, а какие можно вырастить в домашних условиях.

Используя различную литературу по данной теме, изучить химический состав и свойства кристаллов.Узнать, какие виды кристаллов существуют.Вырастить кристалл в домашних условиях.

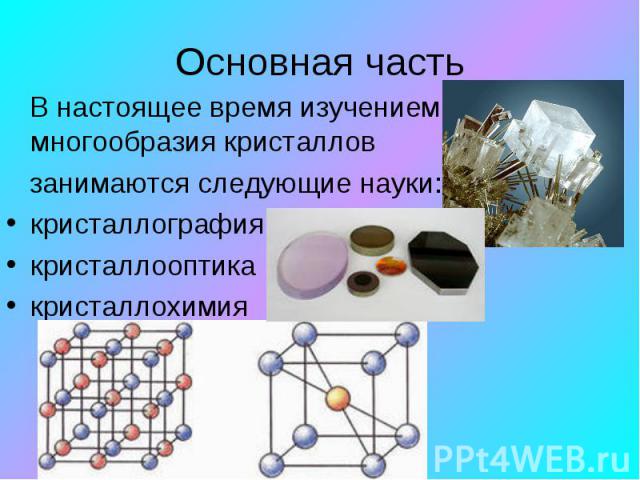
В настоящее время изучением многообразия кристаллов занимаются следующие науки: кристаллография кристаллооптика кристаллохимия

Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов).

Полиморфные модификации Сера Алмаз Графит

Виды кристаллов Идеальный кристалл является математическим объектом, имеющим полную, свойственную ему симметрию, идеализированно ровные гладкие грани и т.д.Реальный кристалл всегда содержит различные дефекты внутренней структуры решетки, искажения и неровности на гранях и имеет пониженную симметрию многогранника вследствие специфики условий роста, неоднородности питающей среды, повреждений и деформаций.

Анизотропия кристаллов Многим кристаллам присуще свойство анизотропии, то есть зависимость их свойств от направления, тогда как в изотропных веществах (большинстве газов, жидкостей, аморфных твёрдых телах) или псевдоизотропных (поликристаллы) телах свойства от направлений не зависят.

Строение кристаллов В зависимости от строения, кристаллы делятся на:ионныековалентныемолекулярныеметаллические

Ионные кристаллы построены из чередующихся катионов и анионов, которые удерживаются в определенном порядке силами электростатического притяжения и отталкивания. Электростатические силы ненаправленные: каждый ион может удержать вокруг себя столько ионов противоположного знака, сколько помещается. Но при этом силы притяжения и отталкивания должны быть уравновешены и должна сохраняться общая электронейтральность кристалла. Ионные кристаллы образуют большинство солей неорганических и органических кислот, оксиды, гидроксиды, соли.

В ковалентных кристаллах (их еще называют атомными) в узлах кристаллической решетки находятся атомы, одинаковые или разные, которые связаны ковалентными связями. Эти связи прочные и направлены под определенными углами. Типичным примером является алмаз; в его кристалле каждый атом углерода связан с четырьмя другими атомами, находящимися в вершинах тетраэдра.

Молекулярные кристаллы построены из изолированных молекул, между которыми действуют сравнительно слабые силы притяжения. В результате такие кристаллы имеют намного меньшие температуры плавления и кипения, твердость их низка. Так, кристаллы благородных газов (они построены из изолированных атомов) плавятся уже при очень низких температурах. Из неорганических соединений молекулярные кристаллы образуют многие неметаллы (благородные газы, водород, азот, белый фосфор, кислород, сера, галогены), соединения, молекулы которых образованы только ковалентными связями (H2O, HCl, NH3, CO2 и др.).

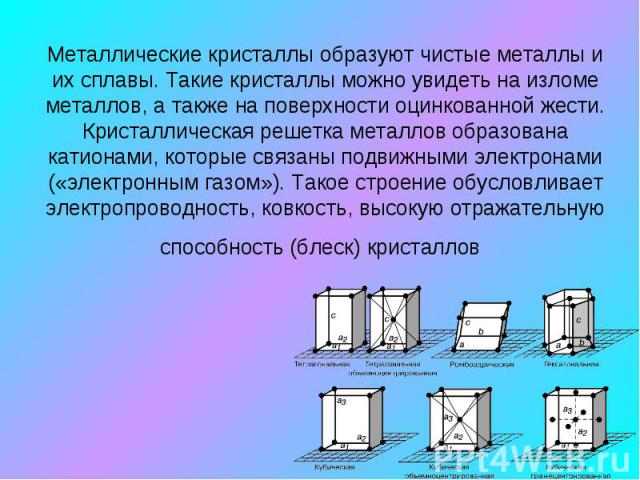
Металлические кристаллы образуют чистые металлы и их сплавы. Такие кристаллы можно увидеть на изломе металлов, а также на поверхности оцинкованной жести. Кристаллическая решетка металлов образована катионами, которые связаны подвижными электронами («электронным газом»). Такое строение обусловливает электропроводность, ковкость, высокую отражательную способность (блеск) кристаллов

Вот простая модель, поясняющая суть кристаллизации. Представим, что в большом зале укладывают паркет. Легче всего работать с плитками квадратной формы – как ни поверни такую плитку, она все равно подойдет к своему месту, и работа пойдет быстро. Именно поэтому легко кристаллизуются соединения, состоящие из атомов (металлы, благородные газы) или небольших симметричных молекул. Такие соединения, как правило, не образуют некристаллических (аморфных) веществ. Труднее выложить паркет из прямоугольных дощечек, особенно если у них с боков имеются пазы и выступы – тогда каждую дощечку можно уложить на свое место одним единственным способом. Особенно трудно выложить паркетный узор из дощечек сложной формы. Если паркетчик очень торопится, то плитки будут поступать к месту укладки слишком быстро. Понятно, что правильного узора теперь не получится: если хотя бы в одном месте плитку перекосит, то дальше все пойдет криво, появятся пустоты (как в старой компьютерной игре «Тетрис», в которой «стакан» заполняется деталями слишком быстро). Ничего хорошего не получится и в том случае, если в большом зале начнут укладывать паркет сразу десяток мастеров – каждый со своего места. Даже если они будут работать не спеша, крайне сомнительно, чтобы соседние участки оказались хорошо состыкованными, и в целом, вид у помещения получится весьма неприглядным: в разных местах плитки расположены в разном направлении, а между отдельными участками ровного паркета зияют дыры. Примерно те же процессы происходят и при росте кристаллов.

Способы выращивания кристаллов выращивания кристаллов путем постепенного охлаждения насыщенного раствора постепенное удаление воды из насыщенного растворавыращивание кристаллов из расплавленных веществ при медленном охлаждении жидкости

Иногда насыщенный раствор при охлаждении не кристаллизуется. Такой раствор, который содержит в определенном количестве растворителя больше растворенного вещества, чем это «положено» при данной температуре, называется пересыщенным раствором. Пересыщенный раствор невозможно получить даже очень длительным перемешиванием кристаллов с растворителем, он может образоваться только путем охлаждения горячего насыщенного раствора. Поэтому такие растворы называют также переохлажденными. В них что-то мешает началу кристаллизации, например, раствор слишком вязкий или для роста кристаллов требуются большие зародыши, которых в растворе нет.

В ходе работы над проектом я реализовала свою цель, а именно, изучила химические составляющие кристаллов, их свойства, а так же на основе полученных знаний, вырастила кристаллы в домашних условиях, помимо этого я подготовила презентацию по изучено теме и составила инструкцию по выращиванию кристаллов в домашних условиях. Все это стало возможным, благодаря четко поставленным мной задачам. Поэтому цель, которую я ставила перед началом работы над проектом, реализована полностью. Моя работа представлялась на уроках химии, для учеников 8-9 классов, и заинтересовала их своей яркостью и неповторимостью, поэтому они вырастили собственные кристаллы и сейчас в холле нашей гимназии ведется выставка для младших классов, на которой ученики представляют проделанную ими работу.