Презентация на тему: Металлы: общая характеристика

Металлы: общая характеристика. Учитель химии МОБУ СОШ ЛГО с. Пантелеймоновка Г. П. Яценко

Химические элементы – металлы. Из 114 известных элементов – 92 относятся к металлам. Металлы – это химические элементы, атомы которых отдают электроны внешнего ( предвнешнего) электронного слоя, превращаясь в положительные ионы (катионы).
![Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] Главные особенности элементов металлов. Малое число валентных электронов ( [1-3]](https://fs3.ppt4web.ru/images/132018/172004/310/img2.jpg)
Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно большие радиусы атомов. Небольшие значения электроотрицательности (от 0,7 до 1,9). Исключительно восстановительные свойства ( - свои электроны). Некоторые химические элементы металлы обладают двойственными свойствами (амфотерность).

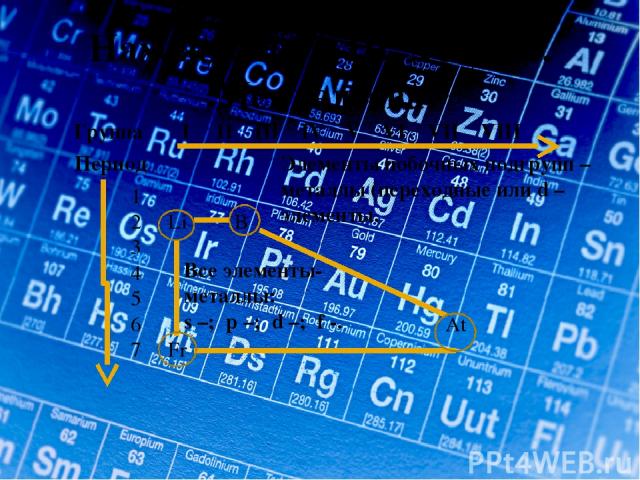
Нахождение в ПСХЭ Д.И. Менделеева Группа I II III IV V VI VII VIII Период 1 2 Li B 3 4 5 6 At 7 Fr Все элементы- металлы: s –; p –; d –; f -. Элементы побочных подгрупп – металлы (переходные или d – элементы.

Изменение свойств в ПСХЭ Д.И. Менделеева Число электронов на внешнем слое не изменяется Радиус атома увеличивается Электроотрицательность уменьшается Восстановительные свойства усиливаются Металлические свойства усиливаются В главной подгруппе

Изменение свойств в ПСХЭ Д.И. Менделеева В периоде: Заряды ядер увеличиваются Радиусы атомов уменьшаются Число электронов на внешнем слое увеличивается Электроотрицательность увеличивается Восстановительные свойства уменьшаются Металлические свойства ослабевают
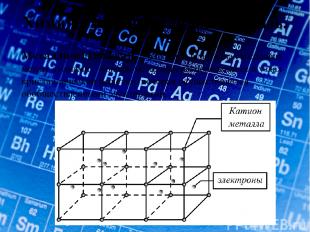
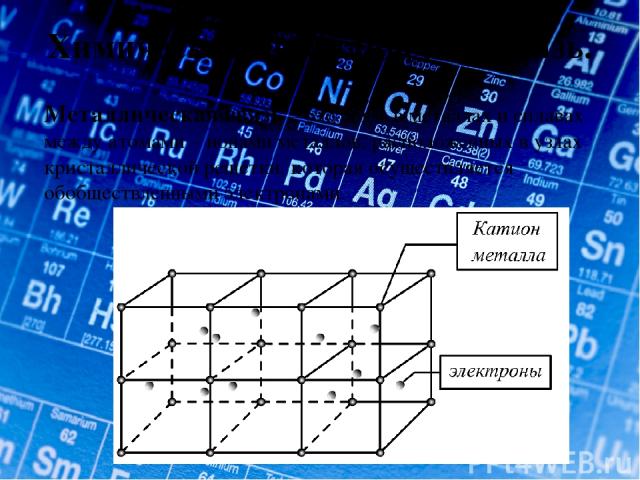
Химическая металлическая связь. Металлическая связь – это связь в металлах и сплавах между атомами – ионами металлов, расположенных в узлах кристаллической решетки, которая осуществляется обобществленными электронами.
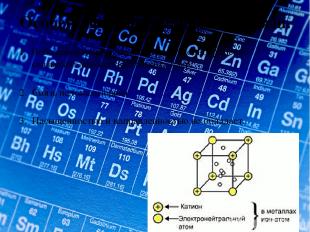
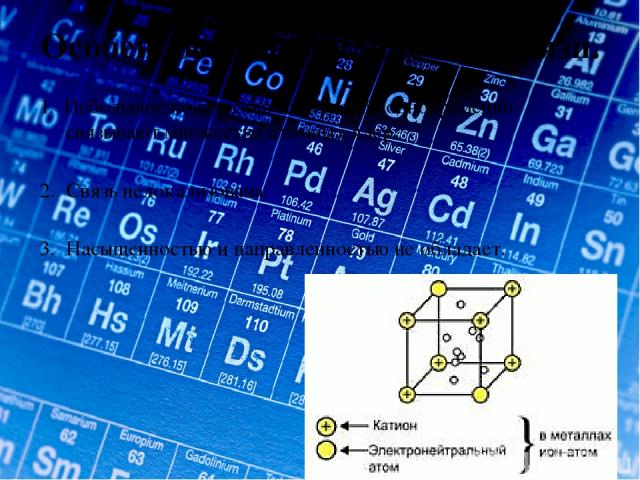
Особенности металлической связи. 1. Небольшое количество электронов одновременно связывают множество атомных ядер. 2. Связь нелокализована. 3. Насыщенностью и направленностью не обладает.

Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Пластичность – смещение слоев ионов под внешним воздействием на кристалл относительно друг друга. Металлический блеск – наличие свободных электронов. Электро- и теплопроводность – обусловлена нахождением в кристалле хаотически движущихся электронов.

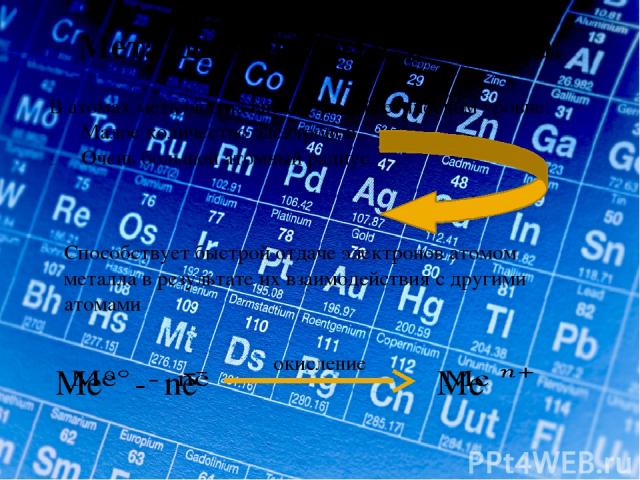
Металлы – простые вещества. В атомах металлов на внешнем энергетическом уровне: Малое количество электронов. Очень большой атомный радиус. Способствует быстрой отдаче электронов атомом металла в результате их взаимодействия с другими атомами окисление

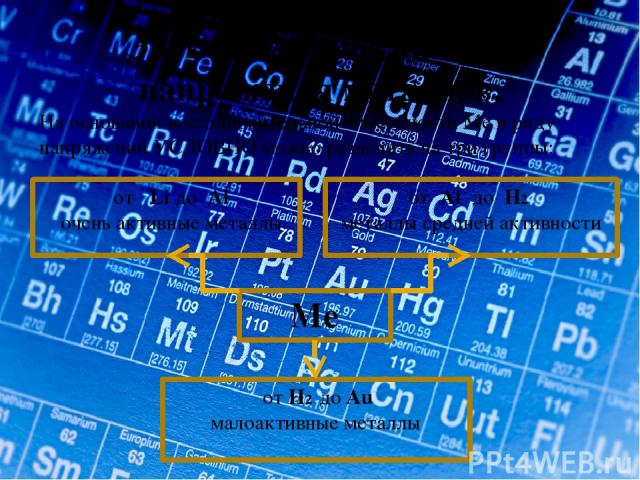
Электрохимический ряд напряжения металлов. Ме расположены в порядке убывания восстановительных свойств при реакциях в растворах; Ме, стоящий в ряду до водорода, вытесняет его из растворов кислот; Ме, стоящий в ряду левее, вытесняет правее стоящий Ме из растворов его солей;

Электрохимический ряд напряжения металлов. Ме, стоящие в ряду до Al, взаимодействуют с водой с образованием щелочей и выделением водорода; остальные Ме – в жестких условиях с образованием оксида Ме и водорода; Ме, стоящие в ряду за водородом, не взаимодействуют с водой;

Электрохимический ряд напряжения металлов. На основании восстановительной способности Ме в ряду напряжений УСЛОВНО можно разделить на три группы: от Li до Al очень активные металлы. Me от Al до H2 металлы средней активности от Н2 до Au малоактивные металлы

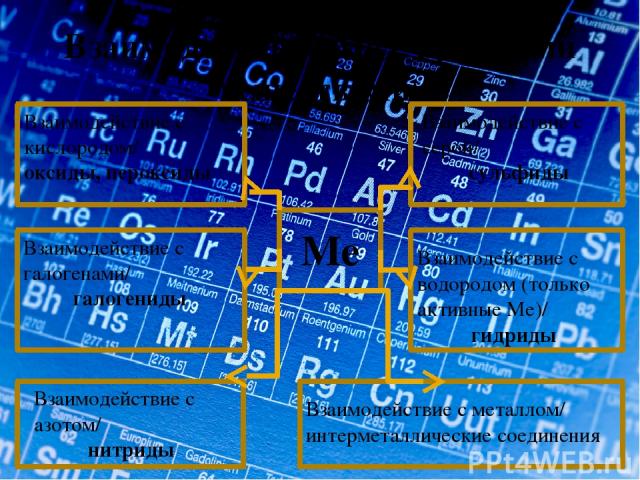
Взаимодействие Ме с простыми веществами. Ме Взаимодействие с кислородом/ оксиды, пероксиды Взаимодействие с серой/ сульфиды Взаимодействие с галогенами/ галогениды Взаимодействие с водородом (только активные Ме)/ гидриды Взаимодействие с азотом/ нитриды Взаимодействие с металлом/ интерметаллические соединения
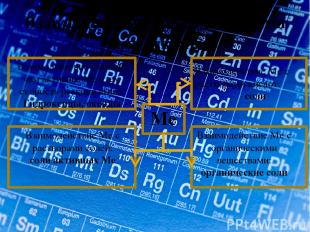
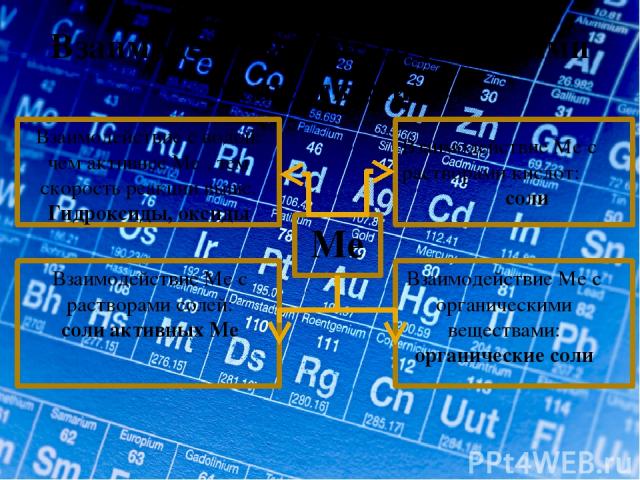
Взаимодействие Ме со сложными веществами. Ме Взаимодействие с водой: чем активнее Ме , тем скорость реакции выше. Гидроксиды, оксиды Взаимодействие Ме с растворами кислот: соли Взаимодействие Ме с растворами солей: соли активных Ме Взаимодействие Ме с органическими веществами: органические соли

Проверь себя На основании положения металлов в электрохимическом ряду напряжений обоснуйте возможность протекания следующих химических реакций: I вариант II вариант Zn и CuSO4 a) AlCl3 и Au Al и H2O b) Fe и H2O Cu и HCl c) Mg и HCl Na и H2O d) Al и FeCl3 Fe и AlCl3 e) Hg и H2O Составьте уравнения возможных химических реакций. I а); b); d); II b); c); d).

https://encrypted-tbn3.gstatic.com/images?q=tbn:ANd9GcTG0PzzdMcXtIsg5QPIh0LKhMa7f4aUyPOa-mHTURTWw1oV-OC3nw http://lookbio.ru/wp-content/uploads/2014/12/shutterstock_118765843.jpg https://encrypted-tbn1.gstatic.com/images?q=tbn:ANd9GcSciQ3qJcw_dUDdrrzJu9xx0ZPclWmdtnjACptaVMGBZSlZeCBS http://www.syl.ru/misc/i/ai/149004/463627.png http://rudocs.exdat.com/data/13/12590/12590_html_m1a2f6902.png http://d3mlntcv38ck9k.cloudfront.net/content/konspekt_image/16378/c58627b8e2adc0bccec05caa5b462fbc.jpg http://doc4web.ru/uploads/files/34/33409/hello_html_5e9becbb.jpg


![Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно большие радиусы атомов. Небольшие значения электроотрицательности (от 0,7 до 1,9). Исключительно восстановительные свойства ( - свои электроны). Некотор… Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно большие радиусы атомов. Небольшие значения электроотрицательности (от 0,7 до 1,9). Исключительно восстановительные свойства ( - свои электроны). Некотор…](https://fs3.ppt4web.ru/images/132018/172004/640/img2.jpg)