Презентация на тему: Химическая кинетика

Химическая кинетика Учитель биологии и химии МОБУ СОШ ЛГО с. Пантелеймоновка Г. П. Яценко

Скорость химической реакции. 2. Химическое равновесие. 3. Способы смещения химического равновесия. Химические реакции и закономерности их протекания.

Учение о скоростях и механизмах химических реакций называется химической кинетикой. Со скоростью химических реакций связаны представления: О превращении веществ. Об экономической эффективности получения веществ в промышленных масштабах. Скорость химических процессов.

Изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы называется скоростью химической реакции. Скорость химической реакции.
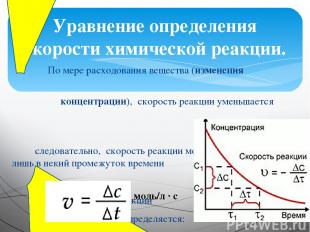
По мере расходования вещества (изменения концентрации), скорость реакции уменьшается следовательно, скорость реакции может быть определена лишь в некий промежуток времени средняя скорость реакции определяется: Уравнение определения скорости химической реакции. моль/л · с

Разновидности химических процессов. Реакции, которые протекают между веществами в неоднородной среде ( есть поверхность раздела между реагирующими веществами), называются гетерогенными. Реакции, которые протекают в однородной среде ( нет поверхности раздела между реагирующими веществами), называются гомогенными.
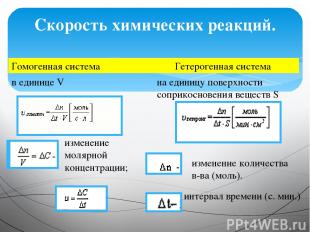
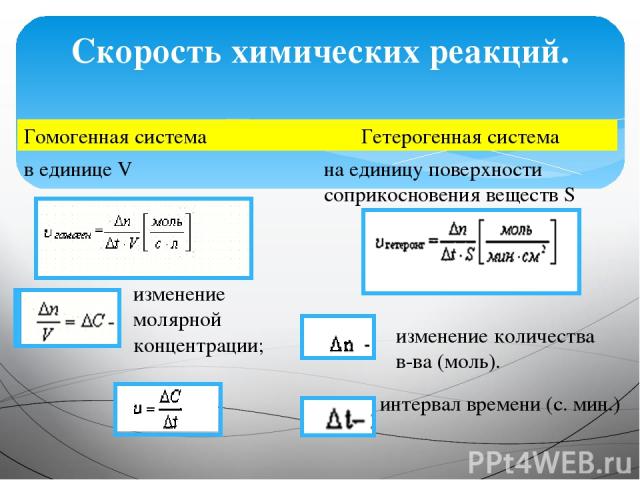
Скорость химических реакций. Гомогенная система Гетерогенная система в единице V изменение молярной концентрации; на единицу поверхности соприкосновения веществ S изменение количества в-ва (моль). интервал времени (с. мин.)
Историческая справка. Французский химик, академик. Впервые разработал основные закономерности протекания химических реакций. Основатель учения о химическом равновесии. Клод Луи Бертолле (1748 – 1822)

Историческая справка. Якоб Хендрик Вант-Гофф (1852 – 1911) Голландский химик и физик, первый лауреат Нобелевской премии по химии (1901). Один из основателей структурной химии, химической кинетики, учения о растворах.

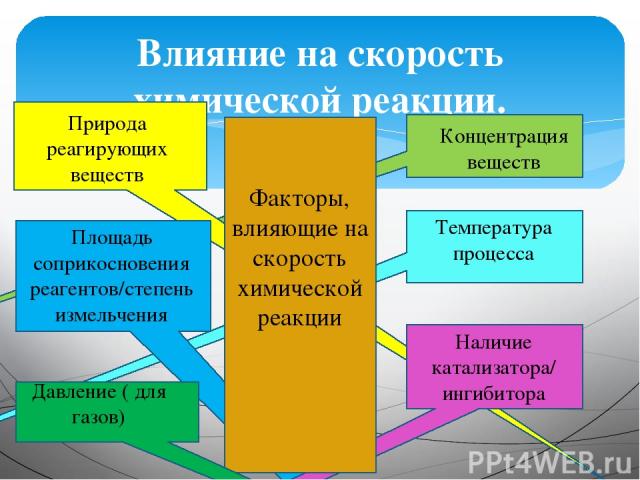
Влияние на скорость химической реакции. Природа реагирующих веществ Площадь соприкосновения реагентов/степень измельчения Концентрация веществ Температура процесса Наличие катализатора/ ингибитора Факторы, влияющие на скорость химической реакции Давление ( для газов)

Зависимость скорости реакции от условий её проведения. Скорость химической реакции зависит от: а) концентрации реагирующих веществ чем выше концентрация, тем чаще молекулы или ионы будут сталкиваться, тем больше превращений веществ произойдет за единицу времени.

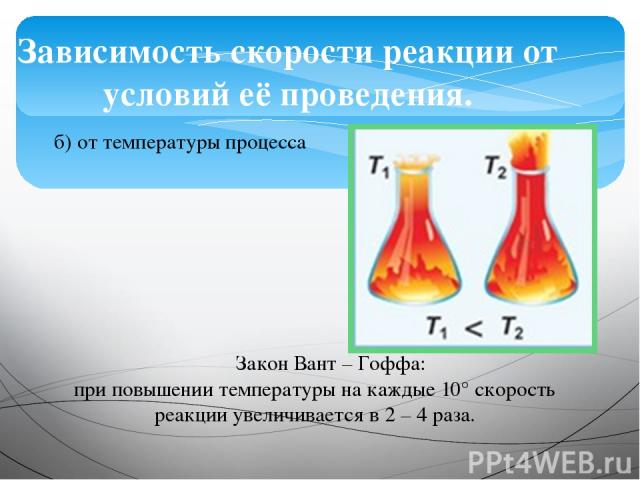
Зависимость скорости реакции от условий её проведения. б) от температуры процесса Закон Вант – Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается в 2 – 4 раза.
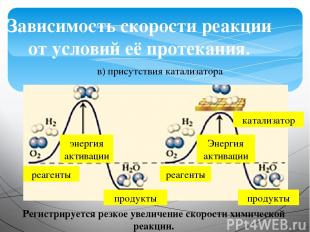
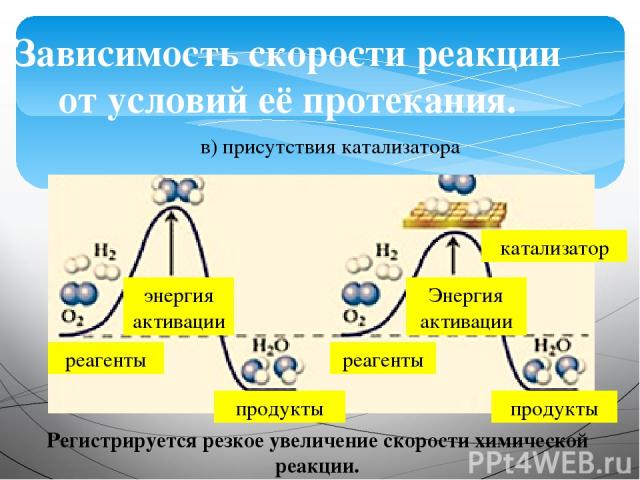
Зависимость скорости реакции от условий её протекания. в) присутствия катализатора реагенты продукты реагенты продукты катализатор энергия активации Энергия активации Регистрируется резкое увеличение скорости химической реакции.

Зависимость скорости реакции от условий её протекания. г) площадь соприкосновения реагирующих веществ чем больше площадь соприкосновения, тем выше скорость химической реакции. мазут воздух Схема действия форсунки для сжигания мазута.

Зависимость скорости реакции от условий её протекания. д) природа реагирующих веществ. взрыв горение Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.

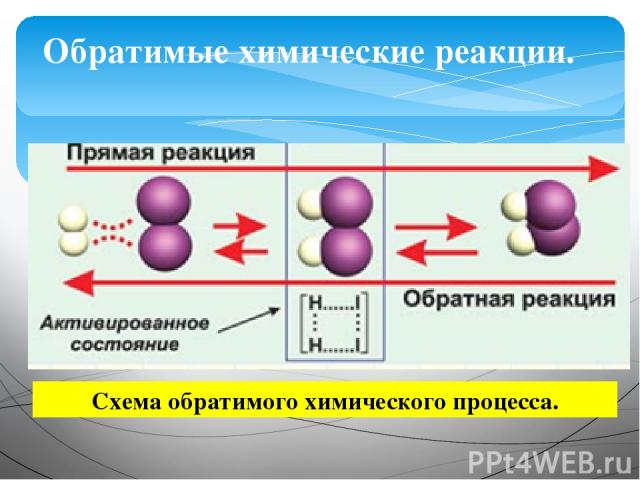
Химические реакции, протекающие в одном направлении, называются необратимыми. Химические реакции, при одних и тех же условиях протекающие и прямом и обратном направлении, называются обратимыми. Типы химических реакций ( по направлению процесса).
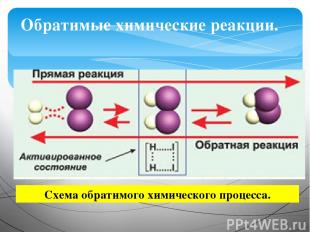
Обратимые химические реакции. Схема обратимого химического процесса.

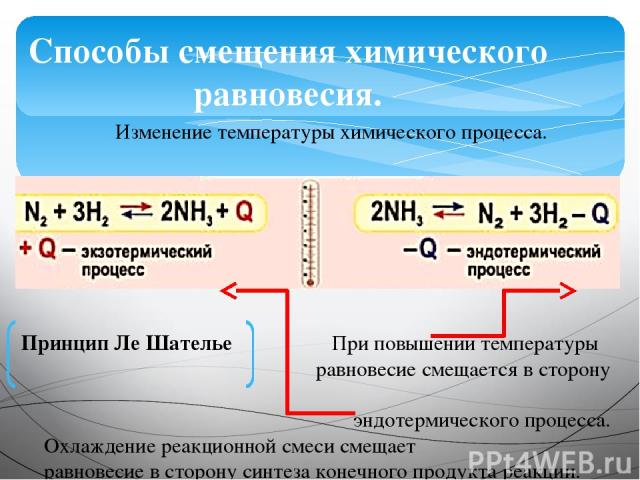
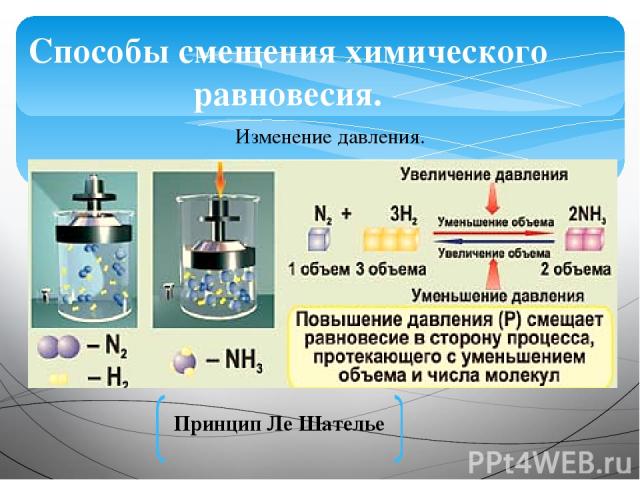
Историческая справка. Анри Луи Ле Шателье (1850 – 1936) Занимался исследованием химического равновесия ( кинетика). Вывел принцип смещения химического равновесия ( принцип Ле Шателье): если находящееся в химическом равновесии система подвергается внешнему воздействию, то в ней возникают процессы, стремящиеся ослабить это воздействие.
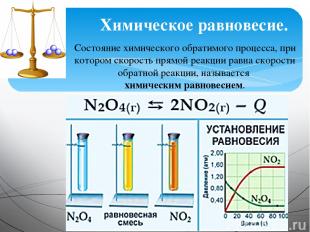
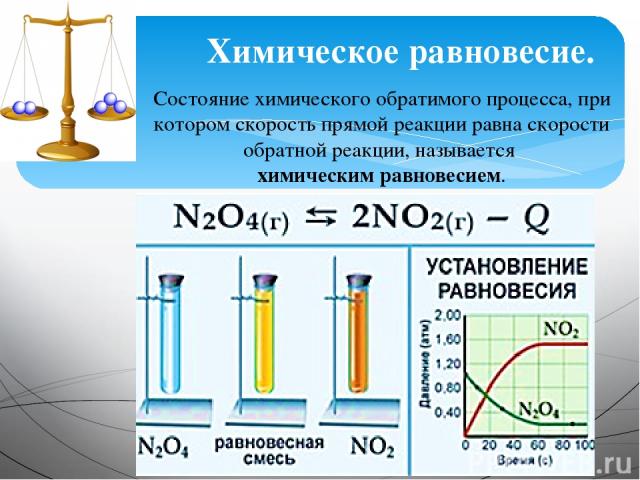
Химическое равновесие. Состояние химического обратимого процесса, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.

Способы смещения химического равновесия. Изменение равновесных концентраций (концентраций веществ после установления равновесия). Чтобы сместить равновесие в сторону образования продуктов реакции, нужно увеличить концентрацию исходных химических веществ. Принцип Ле Шателье
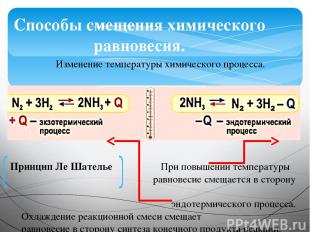
Способы смещения химического равновесия. Изменение температуры химического процесса. При повышении температуры равновесие смещается в сторону эндотермического процесса. Охлаждение реакционной смеси смещает равновесие в сторону синтеза конечного продукта реакции. Принцип Ле Шателье

Способы смещения химического равновесия. Изменение давления. Принцип Ле Шателье

https://encryptedtbn1.gstatic.com/images?q=tbn:ANd9GcTmkjq8o9PP1MPlDPUUe8J7oxxC47gLRC6m8mH5esSZLDQOjpS6 http://images.myshared.ru/320019/slide_2.jpg http://arhe.msk.ru/wp-content/uploads/2014/11/e2f34abf08552e65bd107600e793b75d-335x256.jpg https://encryptedtbn3.gstatic.com/images?q=tbn:ANd9GcRFTgjEjjn4aTT9vgFkh30OFmgmlOtSLhwdpMu6vHfW_e_p2EET http://www.nobelpreis.org/russian/chemie/images/hoff.jpg http://fb.ru/misc/i/gallery/10475/7254.jpg https://encrypted-tbn0.gstatic.com/images?q=tbn:ANd9GcRCmavGqkUDFSMjZ0uWsKVrisnSYy-NRCahu_3y_MOgCXBEsskO http://www.varson.ru/images/Himia_jpeg_big/4-09.jpg Материалы, используемые для оформления.

Информация для педагога. Образовательный ресурс несет информацию об основных понятиях химической кинетики программы общеобразовательной школы. Используется: как иллюстрационный материал при изучении темы «Химические реакции и закономерности их течения» общая химия, 11 класс; как материал для подготовки к ЕГЭ по предмету «Химия»; как учебный материал при организации и проведении дистанционного обучения. Материал адоптирован под УМК О. С.Габриеляна.