Презентация на тему: КИСЛОРОД И СЕРА

Урок по химии в 10 классе: «Кислород и сера» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Костюкевич Юрий Михайлович
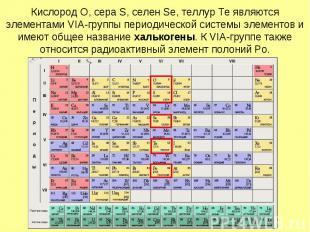
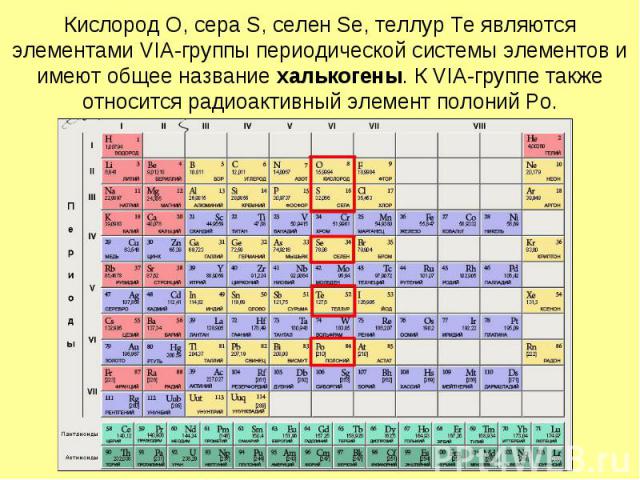
Кислород O, сера S, селен Se, теллур Te являются элементами VIА-группы периодической системы элементов и имеют общее название халькогены. К VIA-группе также относится радиоактивный элемент полоний Po.
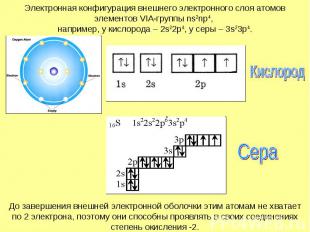
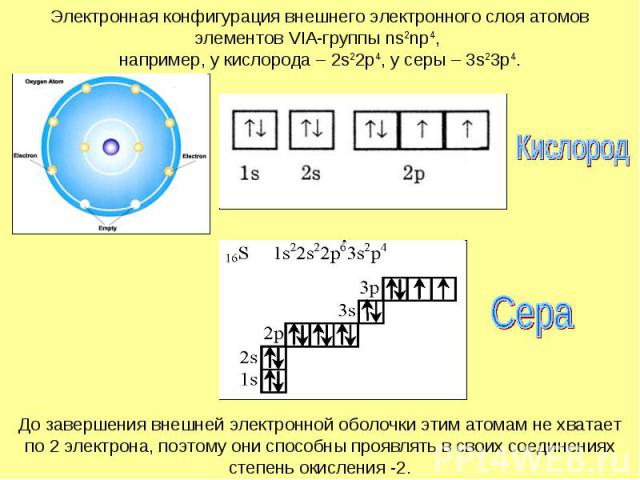
Электронная конфигурация внешнего электронного слоя атомов элементов VIA-группы ns2np4, например, у кислорода – 2s22p4, у серы – 3s23p4.
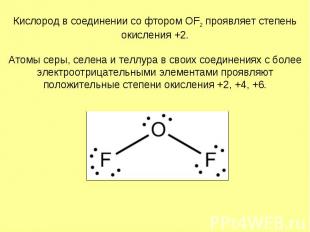
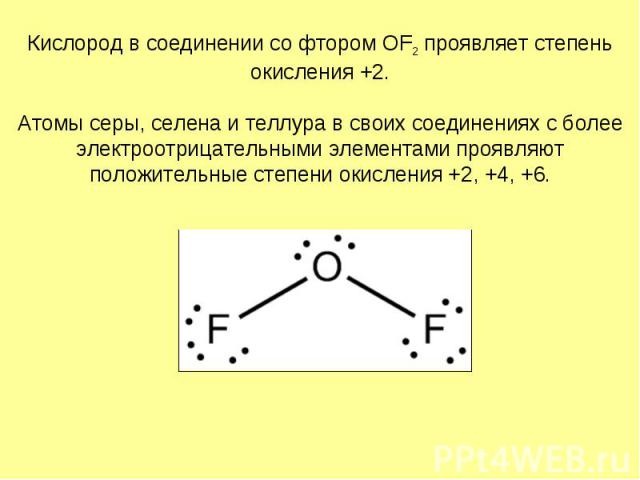
Кислород в соединении со фтором OF2 проявляет степень окисления +2. Атомы серы, селена и теллура в своих соединениях с более электроотрицательными элементами проявляют положительные степени окисления +2, +4, +6.

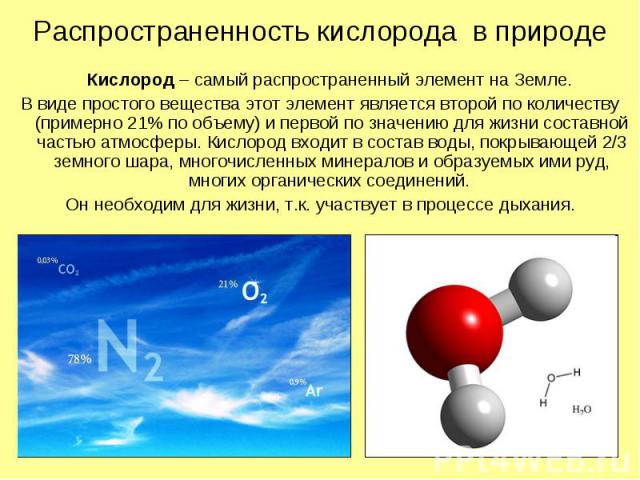
Распространенность кислорода в природе Кислород – самый распространенный элемент на Земле. В виде простого вещества этот элемент является второй по количеству (примерно 21% по объему) и первой по значению для жизни составной частью атмосферы. Кислород входит в состав воды, покрывающей 2/3 земного шара, многочисленных минералов и образуемых ими руд, многих органических соединений. Он необходим для жизни, т.к. участвует в процессе дыхания.

Распространенность серы в природе Сера в природе встречается в самородном состоянии, в виде соединений с металлами – сульфидов и сульфатов. Сера относится к жизненно важным химическим элементам, она входит в состав биологических тканей всех растений и животных.

Кислород
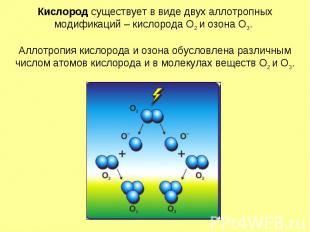
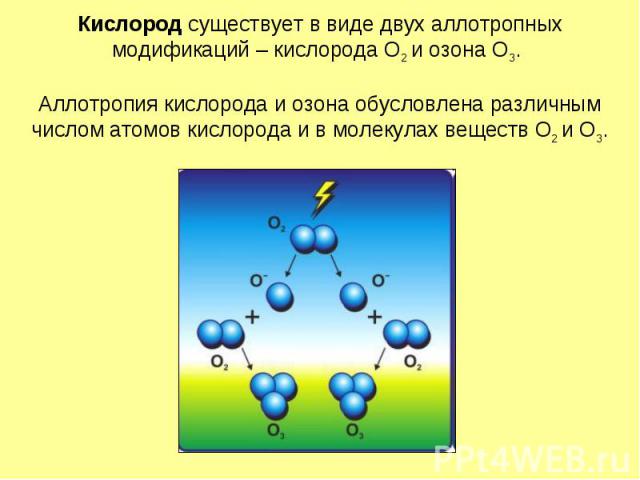
Кислород существует в виде двух аллотропных модификаций – кислорода О2 и озона О3. Аллотропия кислорода и озона обусловлена различным числом атомов кислорода и в молекулах веществ О2 и О3.

Простые вещества кислород и озон различаются по своим химическим свойствам. Кислород непосредственно взаимодействует со всеми простыми веществами, кроме золота, платины и галогенов. Например, кислород способен окислять металлы:

Озон является более сильным окислителем, чем кислород. Многие малоактивные металлы, например серебро, ртуть, он окисляет уже при обычных условиях:
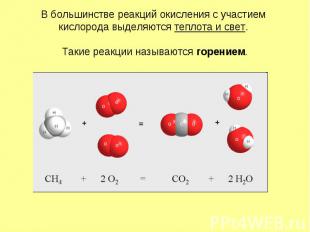
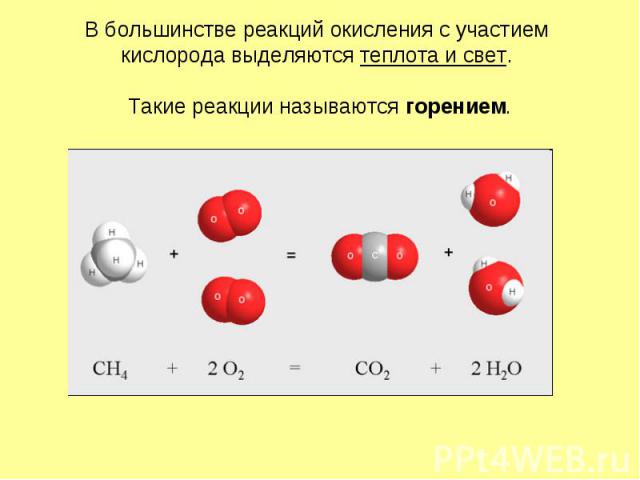
В большинстве реакций окисления с участием кислорода выделяются теплота и свет. Такие реакции называются горением.
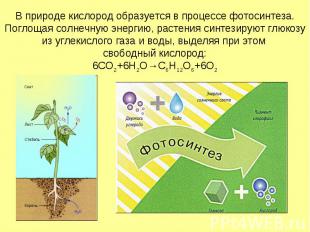
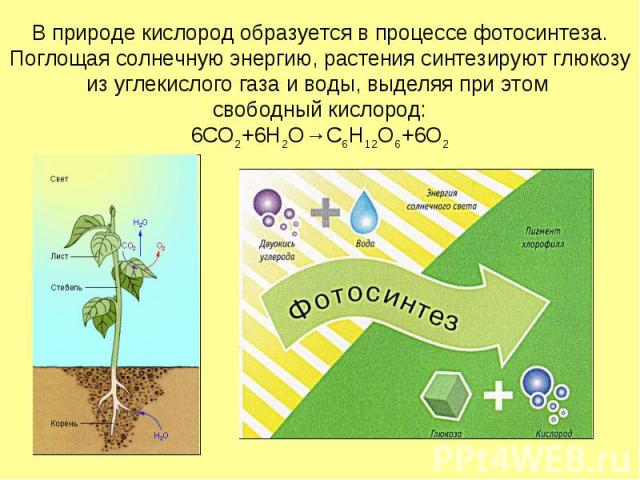
В природе кислород образуется в процессе фотосинтеза. Поглощая солнечную энергию, растения синтезируют глюкозу из углекислого газа и воды, выделяя при этом свободный кислород: 6CO2+6H2O→C6H12O6+6O2

Озон получают при действии электрического разряда на кислород в специальном приборе – озонаторе. В природе озон образуется при грозовых разрядах.
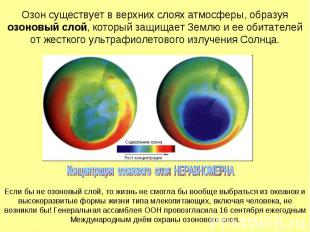
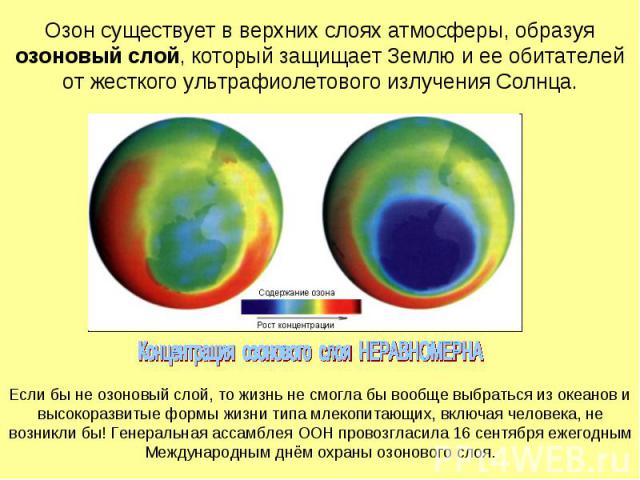
Озон существует в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца.

Применение кислорода Для дыхания: Медицинский кислород хранится в металлических газовых баллонах высокого давления. Для подачи кислорода и кислородно-воздушных смесей применяются кислородные ингаляторы различных моделей и модификаций. - Кислород применяют и для обогащения кислородом водной среды в рыбоводстве.

Применение кислорода - В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива. - В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах. - Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.

Применение озона О3 - при получении многих веществ в лабораторной и промышленной практике; - для отбеливания бумаги; - для очистки воды и воздуха от микроорганизмов (озонирование); - для дезинфекции помещений и одежды.

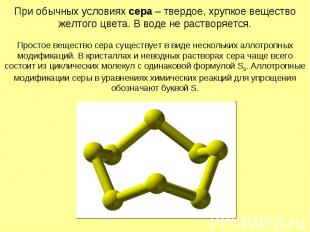
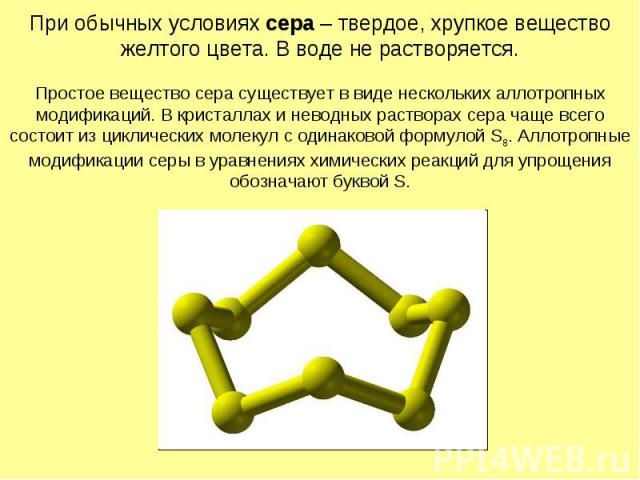
При обычных условиях сера – твердое, хрупкое вещество желтого цвета. В воде не растворяется. Простое вещество сера существует в виде нескольких аллотропных модификаций. В кристаллах и неводных растворах сера чаще всего состоит из циклических молекул с одинаковой формулой S8. Аллотропные модификации серы в уравнениях химических реакций для упрощения обозначают буквой S.

Химические свойства серы Окислительные свойства серы проявляются при ее взаимодействии с металлами, кроме золота и платины, например: Fe+S=FeS Сера взаимодействует с неметаллами, например горит в кислороде: S+O2=SO2 При взаимодействии серы с водородом при высокой температуре образуется сероводород: S+H2↔H2S

Применение серы Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат.


Домашнее задание: Параграф §45.

Список используемых источников http://ru.wikipedia.org/wiki/Кислород http://ru.wikipedia.org/wiki/Сера http://ru.wikipedia.org/wiki/Сульфид_железа(II) http://ru.wikipedia.org/wiki/Озоновый_слой http://shkola.lv/index.php?mode=cht&chtid=367 http://www.innovateus.net/science/what-oxygen http://www.daviddarling.info/encyclopedia/O/oxygen.html http://chemistry-chemists.com/N4/212-247.htm http://www.ebio.ru/org07.html http://www.prostozavod.com.ua/ekotexnologii/ozon-kak-on-vliyaet-na-vsex-nas.html http://www.ua.all.biz/sera-komovaya-kuplyu-sera-tehnicheskaya-v-big-g1925507 http://www.liveinternet.ru/tags/%F1%E5%F0%E0/page3.html http://www.vetlek.ru/shop/?gid=1472&pg=3