Презентация на тему: ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ

Электролиз растворов электролитов урок по химии в 10 классе

Электролиз раствора хлорида меди (II) CuCl2 (-)Катод Cu2+ + 2Cl- Анод(+) восстановление: окисление: Cu2+ +2е- = Сu0 2Cl- - 2е- = Cl2↑ Суммарно: CuCl2 Сu + Cl2 Вывод: электролиз раствора данной соли принципиально не отличается от электролиза ее расплава.

Схема электролиза раствора сульфата меди (II) CuSO4 (-)Катод Cu2+ + SO42- Анод(+) восстановление окисление ионов меди: H2SO4 молекул воды: Cu2+ + 2е- = Сu0 2H2O – 4e- = O2↑ + 4H+ Для подбора коэффициентов используем метод электронно-ионного баланса: К(-) Cu2+ + 2е- = Сu0 2 А(+) 2H2O – 4e- = O2↑ + 4H+ 1 Суммарно: 2CuSO4 + 2H2O 2Cu + O2↑ + 2H2SO4

Анодные процессы в водных растворах электролитов

Изменение восстановительной активности анионов Анионы по их способности окисляться располагаются в следующем порядке: I-, Br-, S2-, Cl-, OH-, SO42-, NO3-, F- Восстановительная активность уменьшается

Электролиз раствора иодида калия KI (-)Катод K+ + I- Анод(+) Восстановление KOH окисление анионов молекул воды: иода: 2H2O + 2e- = Н2↑ + 2ОН- I- - e- = I0 ; 2I = I2 Для подбора коэффициентов используем метод электронно-ионного баланса: К(-) 2H2O + 2e- = Н2↑ + 2ОН- 1 А(+) 2I- - 2e- = I20 ; 1 Суммарно: 2KI + 2H2O Н2↑ + I2 + 2KOH

Катодные процессы в водных растворах электролитов

Электролиз раствора сульфата натрия Na2SO4 (-)Катод 2Na+ + SO42- Анод(+) восстановление окисление молекул воды молекул воды 2H2O + 2e- = Н2↑ + 2ОН- 2H2O – 4e- = O2↑ + 4H+ щелочная среда кислая среда Суммарно: 2H2O 2H2↑ + O2↑ Вывод: электролиз данной соли сводится к разложению воды; соль необходима для увеличения электропроводности, так как чистая вода является очень слабым электролитом.

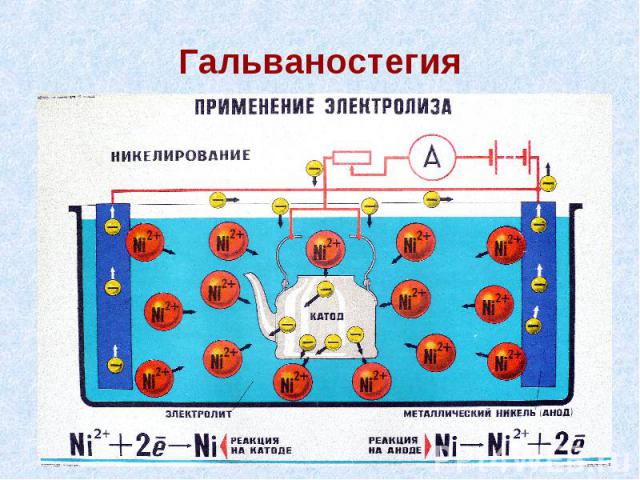
Применение электролиза Электрометаллургия: а) получение активных металлов (K, Na, Ca, Mg, Al и др.) электролизом расплавов природных соединений; б) получение металлов средней активности (Zn, Cd, Co) электролизом растворов их солей. В химической промышленности – получение газов: F2, Cl2, H2, O2; щелочей: NaOH, KOH; пероксида водородаH2O2, тяжелой воды D2O и др. Электролитическое рафинирование – очистка металлов (Cu, Pb, Sn и др.) от примесей электролизом с применением активных (растворимых) анодов. Гальваностегия – нанесение металлических покрытий на поверхность металлического изделия для защиты от коррозии или придания декоративного вида. Например, оцинковка, хромирование, никелирование и пр. Гальванопластика – получение металлических копий с различных матриц, а также покрытие неметаллических предметов слоем металлов. Последний процесс (золочение деревянных статуй и ваз) был известен еще в Древнем Египте, но научные основы гальванопластики были заложены русским ученым Б. Якоби в 1838 г.

Итоговое тестирование 1. Расплав какого вещества подвержен электролизу? а – оксид кальция б – парафин в – глюкоза г – азот 2. Что следует подвергнуть электролизу для получения хлора? а – хлорную воду б – раствор хлората калия в – расплав хлорида калия г – хлор электролизом не получают 3. Цвет лакмуса в околокатодном пространстве при электролизе раствора бромида натрия а – малиновый б – фиолетовый в – красный г – синий 4. Какое вещество нельзя получить при электролизе раствора поваренной соли? а – Na б – H2 в – Cl2 г – NaOH 5. При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется а – Zn б – O2 в – H2 г – SO2 6. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить а – выделение NO2 б – выделение меди в – выделение O2 г – растворение анода

Итоговое тестирование 7. Расставьте анионы в порядке уменьшения их восстановительной активности. Ответ запишите в виде последовательности букв. А – Cl- Б – F- В – I- Г – OH- 8. Вставьте в предложение пропущенные слова: «При никелировании предмет, на который наносят слой никеля, надо соединять с ... полюсом батареи, чтобы он выступал в качестве ... ».

Электролиз раствора поваренной соли

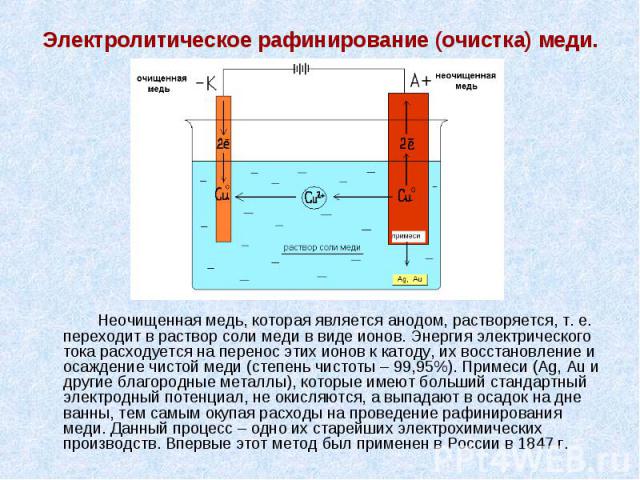
Электролитическое рафинирование (очистка) меди. Неочищенная медь, которая является анодом, растворяется, т. е. переходит в раствор соли меди в виде ионов. Энергия электрического тока расходуется на перенос этих ионов к катоду, их восстановление и осаждение чистой меди (степень чистоты – 99,95%). Примеси (Ag, Au и другие благородные металлы), которые имеют больший стандартный электродный потенциал, не окисляются, а выпадают в осадок на дне ванны, тем самым окупая расходы на проведение рафинирования меди. Данный процесс – одно их старейших электрохимических производств. Впервые этот метод был применен в России в 1847 г.
Гальваностегия