Презентация на тему: ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IVА-ГРУППЫ. УГЛЕРОД. КРЕМНИЙ


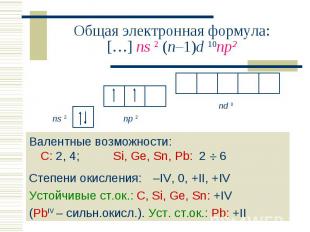
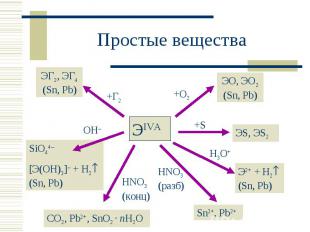
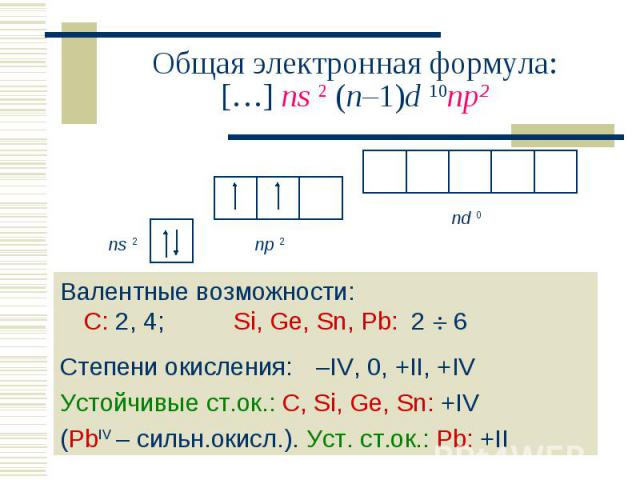
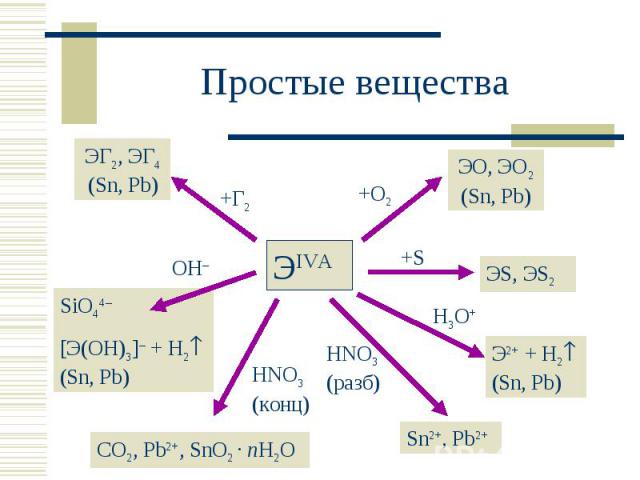
Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 6 Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 6
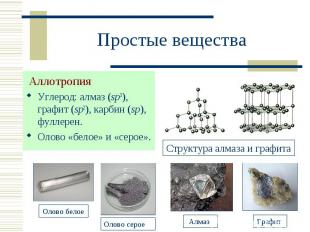
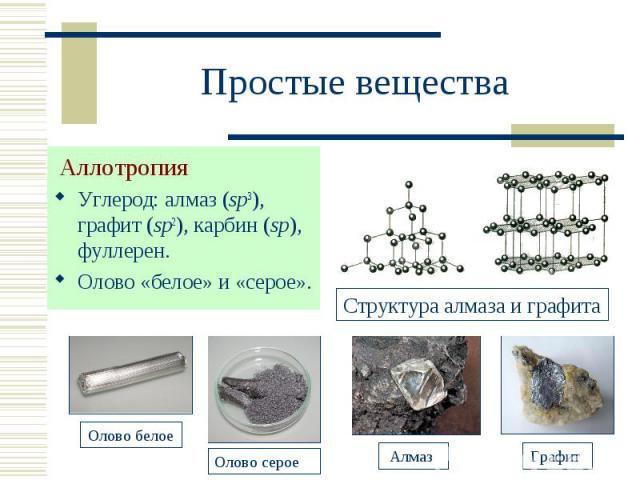
Аллотропия Аллотропия Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Олово «белое» и «серое».

При комн. темп. При комн. темп. С, Si, Ge + H2O С, Si, Ge + H3O+ Sn, Pb + H2O Sn + H3O+ Sn2+ + H2 Pb + H3O+ Pb2+ + H2

С(т) + KOH С(т) + KOH Si + 4NaOH = Na4SiO4 + 2H2 Si + 8OH– –4e – = SiO44– + 4H2O 2H2O + 2e – = H2 + 2OH– Ge + 2KOH + 2H2O2 = K2[Ge(OH)6] Ge + 6OH– –4e – = [Ge(OH)6]2– H2O2 + 2e – = 2OH– Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2 Sn + 3OH– –2e – = [Sn(OH)3]– 2H2O + 2e – = H2 + 2OH–

2. Si 25,80% 2. Si 25,80% (27,72% в литосфере) 13. C 0,087% (0,032% в литосфере) 31. Sn 0,0035% 35. Pb 0,0018% 46. Ge 6 ·10–4% (РРЭ)



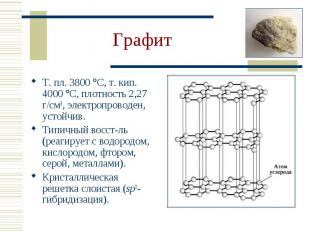
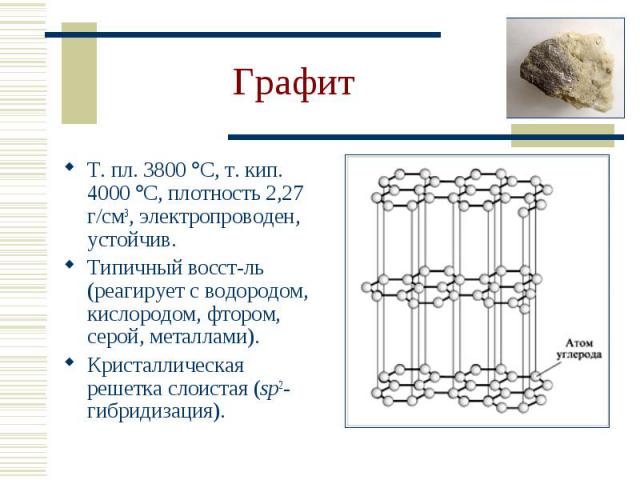
Т. пл. 3800 С, т. кип. 4000 С, плотность 2,27 г/см3, электропроводен, устойчив. Т. пл. 3800 С, т. кип. 4000 С, плотность 2,27 г/см3, электропроводен, устойчив. Типичный восст-ль (реагирует с водородом, кислородом, фтором, серой, металлами). Кристаллическая решетка слоистая (sp2-гибридизация).
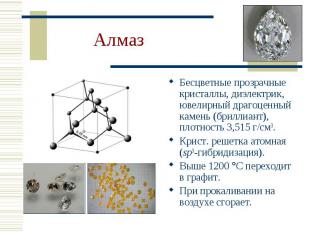
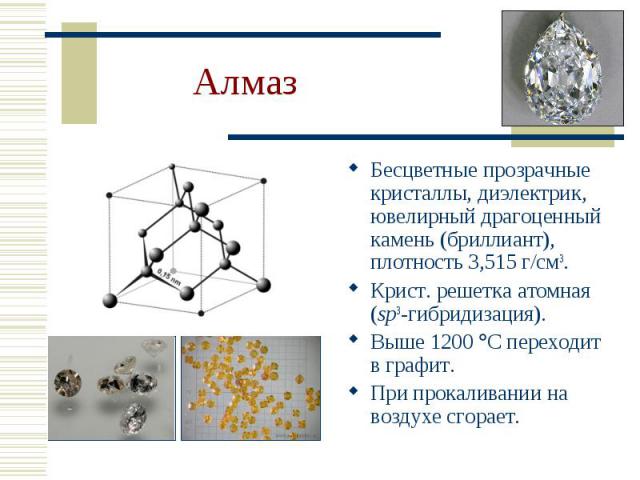
Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3. Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3. Крист. решетка атомная (sp3-гибридизация). Выше 1200 С переходит в графит. При прокаливании на воздухе сгорает.

Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 С переходит в графит. Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 С переходит в графит.

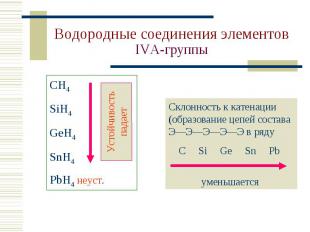
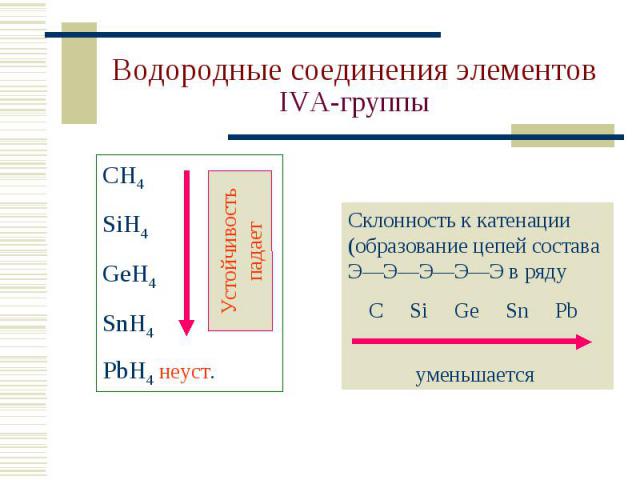
СН4 – газ без цвета и запаха, горюч, главная сост. часть природного газа. СН4 – газ без цвета и запаха, горюч, главная сост. часть природного газа. Получение в лаборатории: CH3COONa + NaOH (+t) = = Na2CO3 + CH4 Горение: CH4 + O2 = С + 2H2O CH4 + 2O2 (изб.) = = СO2 + 2H2O
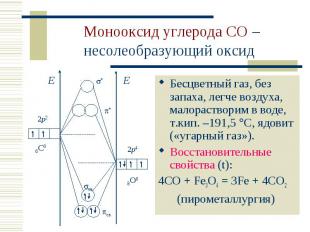
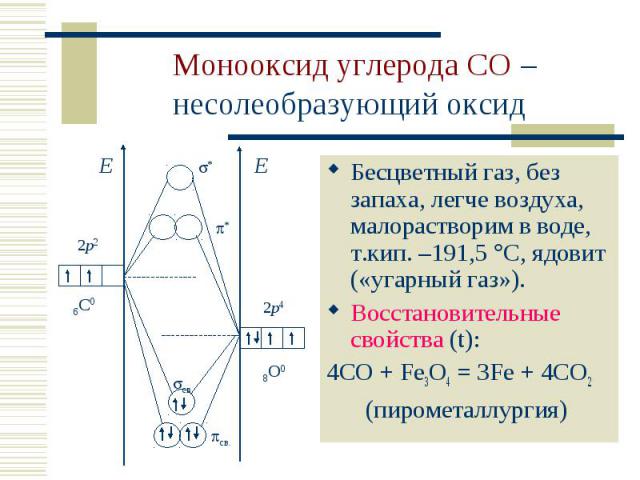
Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т.кип. –191,5 С, ядовит («угарный газ»). Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т.кип. –191,5 С, ядовит («угарный газ»). Восстановительные свойства (t): 4CO + Fe3O4 = 3Fe + 4CO2 (пирометаллургия)

Донорные свойства: Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5].

Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при комн. т-ре в 1 л воды – около 1,7 л CO2). Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при комн. т-ре в 1 л воды – около 1,7 л CO2). В тв. сост. («сухой лёд») – молекулярная крист. решетка; т. возгонки –78 С, т.пл. –57 С (р = 5 атм).

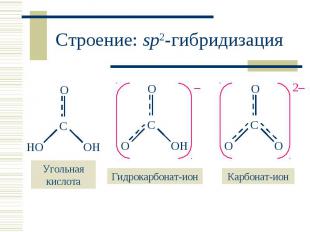
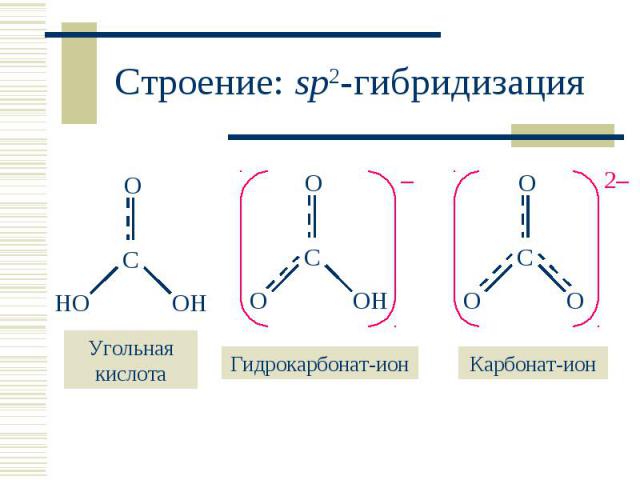
В водном растворе: В водном растворе: CO2 (г) + H2O CO2 . H2O H2CO3 H2CO3 – слабая двухосновная кислота: H2CO3 + H2O HCO3– + H3O+ ; KK = 4,27 · 10–7 HCO3– + H2O CO32– + H3O+ ; KK = 4,68 · 10–11
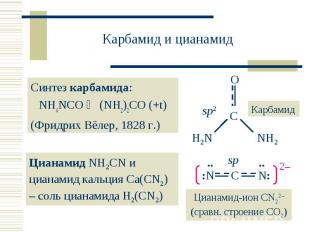
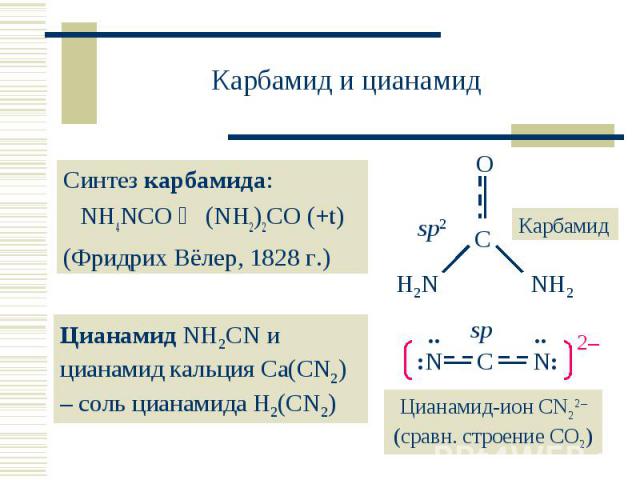
Синтез карбамида: Синтез карбамида: NH4NCO (NH2)2CO (+t) (Фридрих Вёлер, 1828 г.)

Циановодород HCN – бесцв.ж., т. пл. –13,3 С, т.кип. +25,6 С). Циановодород HCN – бесцв.ж., т. пл. –13,3 С, т.кип. +25,6 С). В водн. р-ре – слабая «синильная кислота»: HCN + H2O CN– + H3O+; KK = 4,93 · 10–10 Цианид-ион CN : донорные св-ва, образует прочные комплексы, ядовит.
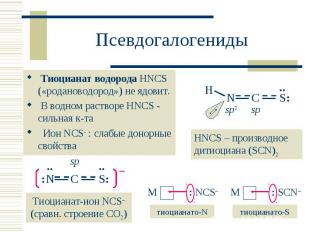
Тиоцианат водорода HNCS («родановодород») не ядовит. Тиоцианат водорода HNCS («родановодород») не ядовит. В водном растворе HNCS - сильная к-та Ион NCS : слабые донорные свойства
![Химическое растворение Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4 Химическое растворение Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4](https://fs1.ppt4web.ru/images/95289/134186/310/img26.jpg)
Химическое растворение Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si + 4NaOH = Na4SiO4 + 2H2 Получение кремния SiO2 + 2Mg = 2MgO + Si SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.)

Моносилан SiH4: Моносилан SiH4: SiH4 + 2O2 = SiO2 + 2H2O Получение силанов: SiO2 + 4Mg(изб) = Mg2Si + 2MgO (силицид магния) Mg2Si + 4H2O = 2Mg(OH)2 + SiH4 Mg2Si + 4H3O+ = 2Mg2+ + 4H2O + SiH4

Полиморфизм диоксида кремния: Полиморфизм диоксида кремния:
![SiO2 + 4HF = SiF4 + 2H2O SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + SiO2 + 4HF = SiF4 + 2H2O SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] +](https://fs1.ppt4web.ru/images/95289/134186/310/img29.jpg)
SiO2 + 4HF = SiF4 + 2H2O SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода)





![С(т) + KOH С(т) + KOH Si + 4NaOH = Na4SiO4 + 2H2 Si + 8OH– –4e – = SiO44– + 4H2O 2H2O + 2e – = H2 + 2OH– Ge + 2KOH + 2H2O2 = K2[Ge(OH)6] Ge + 6OH– –4e – = [Ge(OH)6]2– H2O2 + 2e – = 2OH– Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2 Sn + 3OH– –2e – = [Sn(OH)3]… С(т) + KOH С(т) + KOH Si + 4NaOH = Na4SiO4 + 2H2 Si + 8OH– –4e – = SiO44– + 4H2O 2H2O + 2e – = H2 + 2OH– Ge + 2KOH + 2H2O2 = K2[Ge(OH)6] Ge + 6OH– –4e – = [Ge(OH)6]2– H2O2 + 2e – = 2OH– Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2 Sn + 3OH– –2e – = [Sn(OH)3]…](https://fs1.ppt4web.ru/images/95289/134186/640/img7.jpg)






![Донорные свойства: Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5]. Донорные свойства: Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5].](https://fs1.ppt4web.ru/images/95289/134186/640/img19.jpg)




![Химическое растворение Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si + 4NaOH = Na4SiO4 + 2H2 Получение кремния SiO2 + 2Mg = 2MgO + Si SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.) Химическое растворение Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si + 4NaOH = Na4SiO4 + 2H2 Получение кремния SiO2 + 2Mg = 2MgO + Si SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.)](https://fs1.ppt4web.ru/images/95289/134186/640/img26.jpg)


![SiO2 + 4HF = SiF4 + 2H2O SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода) SiO2 + 4HF = SiF4 + 2H2O SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода)](https://fs1.ppt4web.ru/images/95289/134186/640/img29.jpg)












