Презентация на тему: Общая характеристика элементов VA-группы. Азот

Общая и неорганическая химия. Лекция 21 Общая характеристика элементов VА-группы. Азот
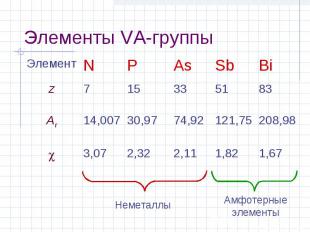
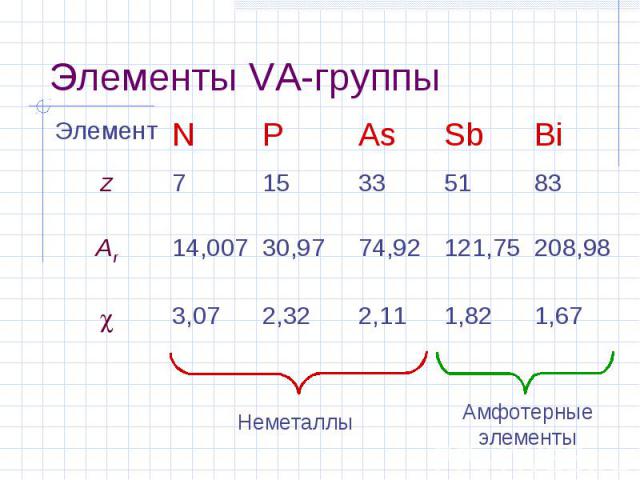
Элементы VA-группы Элемент N P As Sb Bi z 7 15 33 51 83 Ar 14,007 30,97 74,92 121,75 208,98 3,07 2,32 2,11 1,82 1,67 Неметаллы Амфотерные элементы
![Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3 Степени оки Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3 Степени оки](https://fs1.ppt4web.ru/images/3018/54497/310/img2.jpg)
Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3 Степени окисления: –III, 0, +III, +V ns 2 np 3 nd 0 Валентные возможности: N – 3, 4; P, As, Sb, Bi – 3 6
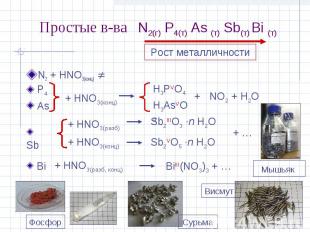
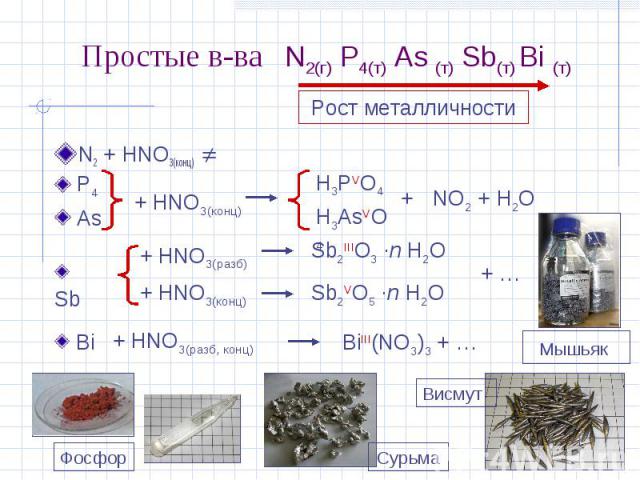
Простые в-ва N2(г) P4(т) As (т) Sb(т) Bi (т) N2 + HNO3(конц) Рост металличности P4 As + HNO3(конц) H3PVO4H3AsVO4 + NO2 + H2O Sb + HNO3(разб) + HNO3(конц) Sb2IIIO3 ·n H2O Sb2VO5 ·n H2O + … Bi + HNO3(разб, конц) BiIII(NO3)3 + … Фосфор Сурьма Висмут Мышьяк
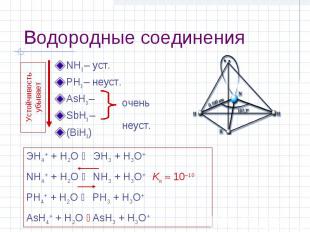
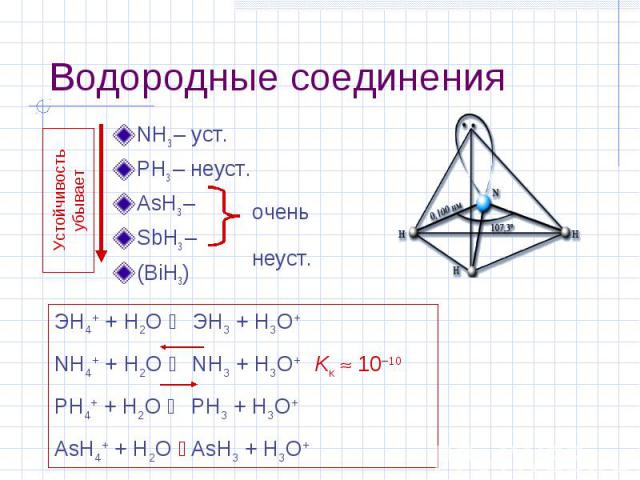
Водородные соединения NH3 – уст. PH3 – неуст. AsH3 – SbH3 – (BiH3) Устойчивость убывает очень неуст. ЭН4+ + H2O ЭН3 + H3O+ NН4+ + H2O NН3 + H3O+ Kк 10–10 PН4+ + H2O PН3 + H3O+ AsН4+ + H2O AsН3 + H3O+

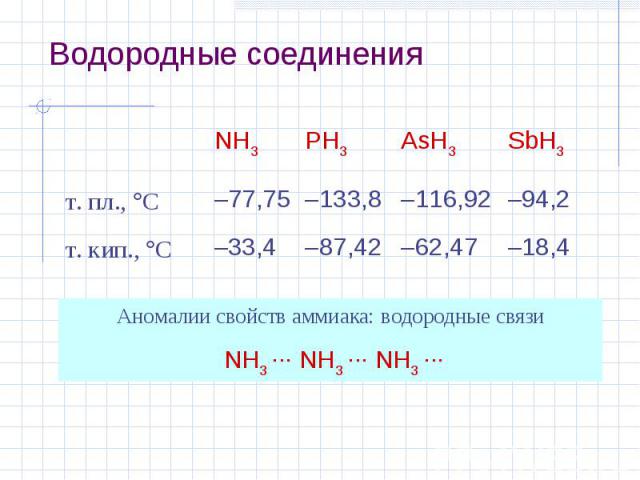
Водородные соединения NH3 PH3 AsH3 SbH3 т. пл., С –77,75 –133,8 –116,92 –94,2 т. кип., С –33,4 –87,42 –62,47 –18,4 Аномалии свойств аммиака: водородные связи NH3 ··· NH3 ··· NH3 ···
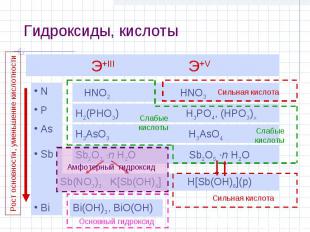
Гидроксиды, кислоты Э+III Э+V N P As Sb Bi HNO2 HNO3 H2(PHO3) H3PO4, (HPO3)x H3AsO3 H3AsO4 Sb2O3 ·n H2O Sb(NO3)3 K[Sb(OH)4] Sb2O5 ·n H2O H[Sb(OH)6](р) Bi(OH)3, BiO(OH) Сильная кислота Слабые кислоты Слабые кислоты Сильная кислота Основный гидроксид Амфотерный гидроксид Рост основности, уменьшение кислотности
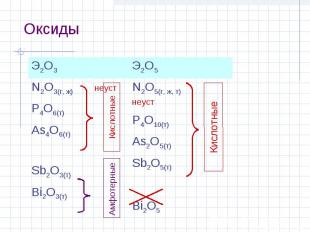
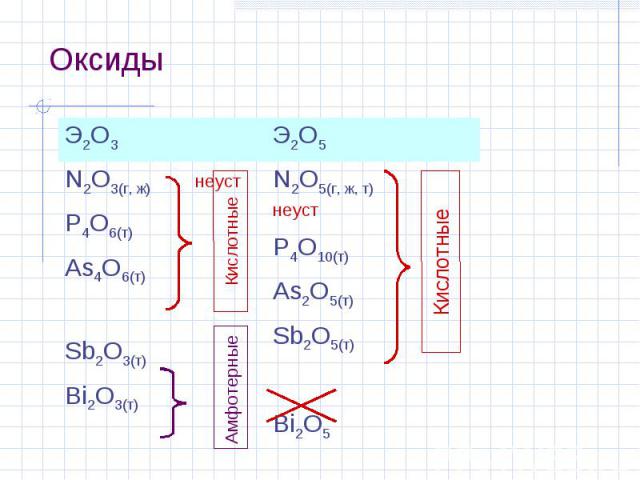
Оксиды Э2О3 Э2О5 N2O3(г, ж) неуст P4O6(т) As4O6(т) Sb2O3(т) Bi2O3(т) N2O5(г, ж, т) неуст P4O10(т) As2O5(т) Sb2O5(т) Bi2O5 Кислотные Кислотные Амфотерные

Степени окисления Ст.ок. +V: P, As, Sb N(+V), Bi(+V) – сильные окислители Ст.ок. +III: P, As, Sb, Bi N(+III) – активный окислитель и восстановитель Ст.ок. 0: N

Распространение в природе 12. P – 0,09 масс.% 16. N – 0,03 масс.% 47. As – 5·10–4 масс.% 62. Sb – 5·10–5 масс.% 66. Bi – 1·10–5 масс.% Азот атмосферы N2 (самородный)

Нитратин (чилийская селитра) NaNO3 Нитрокалит (индийская селитра) KNO3 Нашатырь NH4Cl Нашатырь Нитратин Апатит 3Ca3(PO4)2·Ca(Cl,OH,F)2 Фосфорит Ca3(PO4)2 Фторапатит 3Ca3(PO4)2·CaF2 Апатит Фосфорит Фторапатит Азот, фосфор

Мышьяк, сурьма, висмут Реальгар As4S4 Аурипигмент As2S3 Арсенопирит FeAsS Тетраэдрит Cul2As4S13 Антимонит (сурьмяный блеск) Sb2S3 Висмутин (висмутовый блеск) Bi2S3 Арсенопирит Аурипигмент Реальгар Редкие минералы Анимикит (Ag, Sb) Арсенопалладинит Pd3As Геверсит PtSb2 Стибиопалладинит Pd3Sb Антимонит (стибин)

История открытия элементов Азот: 1772 г., Д. Резерфорд, Г.Кавендиш, 1769-1771 гг., К.Шееле, А.Л. Лавуазье Фосфор: 1669 г., Хённиг Бранд Мышьяк: XIII в., Альберт Великий, XVI в., Парацельс, 1735 г., Г. Брандт Сурьма: 3000 лет до н.э.; XVI в., Парацельс, Василий Валентин, 1735 г., Г. Брандт Висмут: XV-XVI вв., Агрикола, Василий Валентин, 1739 г., И.Потт Фосфор. Джозеф Райт («Райт из Дерби») (1734-1797)

Азот. Шкала степеней окисления +V +III +II +I 0 –I –II –III +IV N2O5, NO3, HNO3, NaNO3, AgNO3 NO2, N2O4 N2O3, NO2, HNO2, NaNO2, NF3 NO, N2O2 H2N2O2 N2 NH2OH, NH3OH+ N2H4, N2H5+, N2H62+ NH3, NH4+, NH3·H2O, NH4Cl, Li3N, Cl3N

Свойства азота N2 – бесцветный газ, без запаха и вкуса, т.пл. –210,0 С, т.кип. –195,8 С малорастворим в воде и орг. р-рителях энергия связи в молекуле N2 равна 945 кДж/моль, длина связи 110 пм. N2 + F2 N2 + 6Li = 2 Li3N нитрид лития (катализатор – вода) Баллоны с азотом N N

Получение и применение азота В промышленности: фракционная дистилляция сжиженного воздуха (жидкий кислород остается в жидкой фазе). В лаборатории: термич. разл. NH4NO2 (расплав, конц. водн. р-р): NH4NO2 = N2 + 2H2O; NH4+ + NO2 = N2 + 2H2O окисление аммиака (без катализатора): 4NH3 + 3O2 = 2N2 + 6H2O Применение Синтез аммиака (… азотная к-та, нитраты и т.д.) Создание инертной атмосферы (металлургия и др.)

Водородные соединения азота NH3 N2H4 NH2OH HN3 G обр. , кДж/моль –16 (г) устойчив +159 (г), +149 (ж) разл. до NH3 и N2 –17 (т) разл. до NH3, N2 и H2O +328 (г), +327 (ж) разл. до N2 и H2 т. пл., С –77,75 +1,4 +32 –80 т. кип., С –33,4 +113,5 +58 (вак.) +35,7
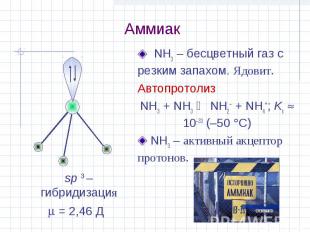
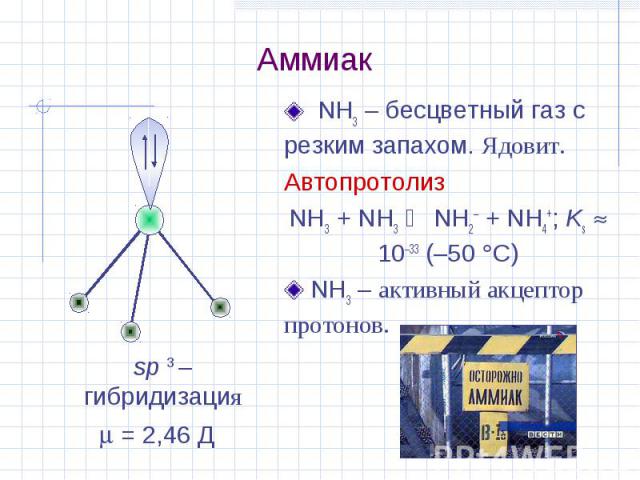
Аммиак NH3 – бесцветный газ с резким запахом. Ядовит. Автопротолиз NH3 + NH3 NH2– + NH4+; Ks 10–33 (–50 С) NH3 – активный акцептор протонов. sp 3 –гибридизация = 2,46 Д

Аммиак в водном растворе Высокая растворимость в воде (в 1 л воды 700 л NH3) Гидратация и протолиз: NH3 + H2O = NH3·H2O NH3 · H2O + H2O NH4+ + OH + H2O; pH 7 Kо = 1,75 · 10–5 N H H H O H H Водородная связь Получение аммиака. «Фонтан» (видео)
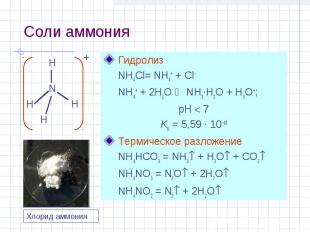
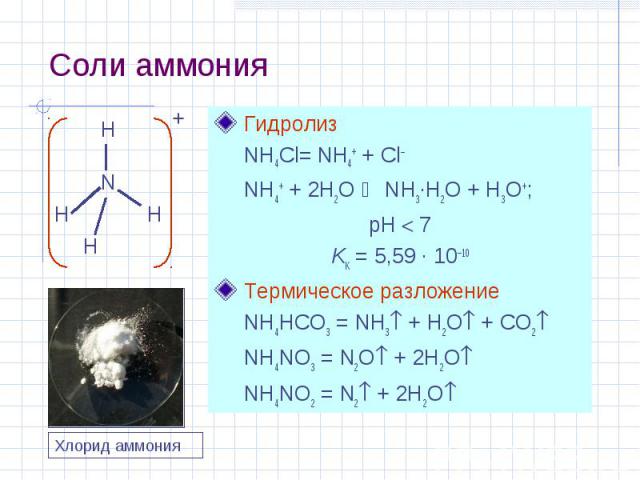
Соли аммония Гидролиз NH4Cl= NH4+ + Cl– NH4+ + 2H2O NH3·H2O + H3O+; pH 7 KK = 5,59 · 10–10 Термическое разложение NH4HCO3 = NH3 + H2O + CO2 NH4NO3 = N2O + 2H2O NH4NO2 = N2 + 2H2O N H H H H + Хлорид аммония

Окислительно-восстановительные свойства Горение 4 NH3 + 3O2 = 2N2 + 6H2O (без кат.) 4 NH3 + 5O2 = 4NO + 6H2O (кат. Pt, Cr2O3) В водном растворе pH 7: 2 NH3·H2O + 6OH 6e = N2 + 8H2O; = –0,74В pH 7: 2NH4+ 6e = N2 + 8H+; = +0,27В 8 NH3·H2O 6e = N2 + 8H2O + 6NH4+; = +0,23В Примеры: 8 NH3·H2O + 3Br2 = N2 + 8H2O + 6 NH4Br 2 NH3·H2O + 2KMnO4 = N2 + 2MnO2 + 4H2O + 2KOH

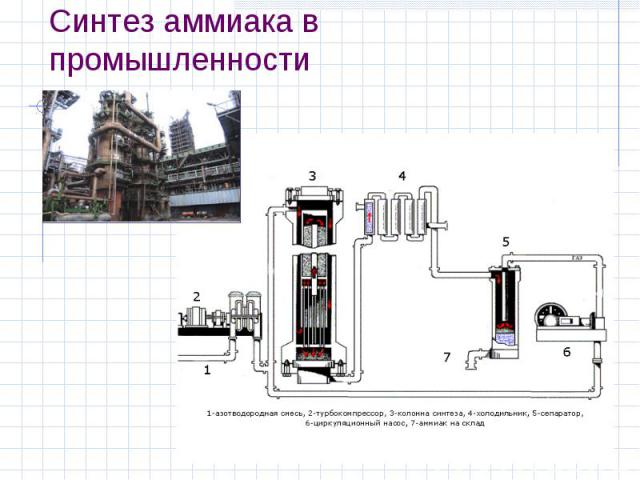
Получение аммиака В промышленности N2 + 3H2 2NH3 + Q (300-500 С, 300 атм, катализатор: Fe, Pt) В лаборатории (при нагревании) NH4Cl + NaOH = = NaCl + H2O + NH3 NH3·H2O = H2O + NH3 Получение аммиака в лаборатории
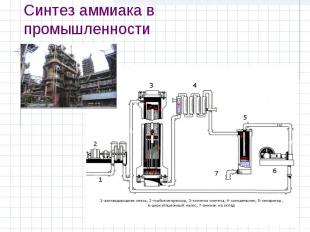
Синтез аммиака в промышленности
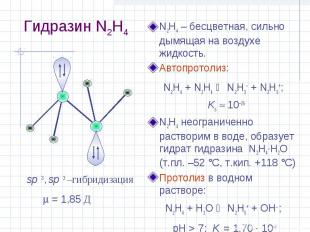
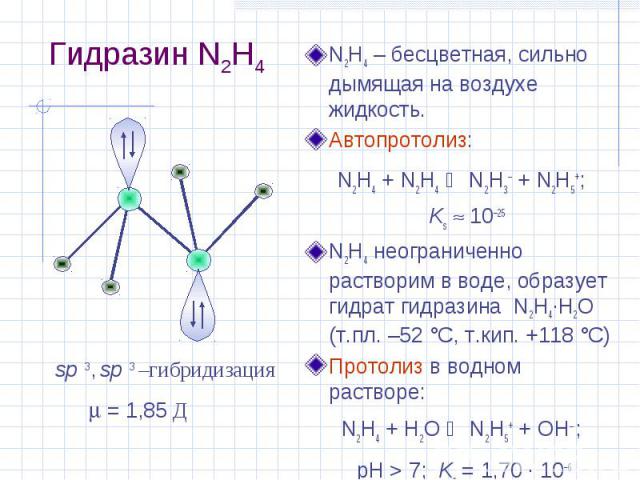
Гидразин N2H4 N2H4 – бесцветная, сильно дымящая на воздухе жидкость. Автопротолиз: N2H4 + N2H4 N2H3– + N2H5+; Ks 10–25 N2H4 неограниченно растворим в воде, образует гидрат гидразина N2H4·H2O (т.пл. –52 °С, т.кип. +118 °С) Протолиз в водном растворе: N2H4 + H2O N2H5+ + OH ; pH > 7; Kо = 1,70 · 10–6 = 1,85 Д sp 3, sp 3 –гибридизация

Протоноакцепторные свойства N2H4 – акцептор протонов (две неподеленные пары электронов): N2H4 + H3O+ = N2H5+ + H2O катион гидразиния(1+) N2H4 + 2H3O+ = N2H62+ + 2H2O катион гидразиния(2+) Соли: [N2H5]Cl, [N2H5]2SO4, [N2H6]SO4 (получ. в изб.к-ты)

Окислительно-восстановительные свойства гидразина Гидразин как восстановитель рН 7: N2H4·H2O + 4OH 4e = N2 + 5H2O; = –1,12В рН 7: N2H5+ 4e = N2 + 5H+; = –0,23 В Гидразин как окислитель рН 7: N2H4·H2O + 3H2O + 2e = 2 NH3·H2O + 2OH; = +0,03 В рН 7: N2H5+ + 3H+ + 2e = 2NH4+; = +1,27 В Восстановительные свойства гидразина ярче выражены в щелочной среде, а окислительные – в кислотной. Пример: N2H4 + 2I2 = N2 + 4 HI (pH 7) Получение: 2NH3 + NaClO = N2H4 + NaCl + H2O
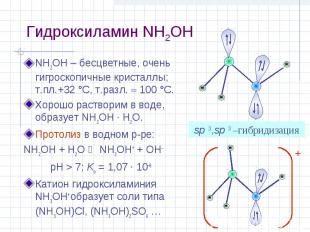
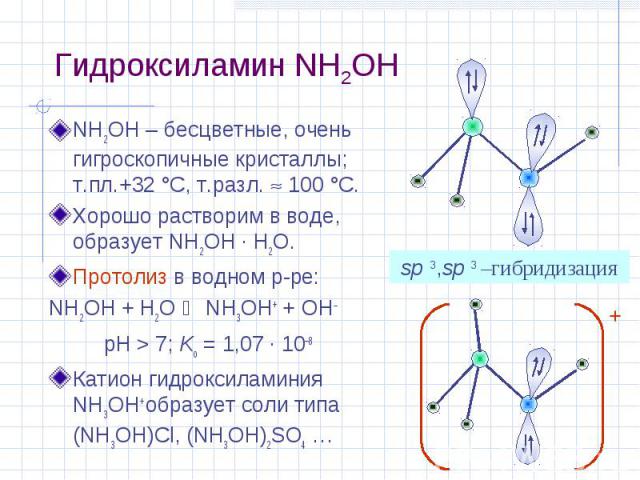
Гидроксиламин NH2OH NH2OH – бесцветные, очень гигроскопичные кристаллы; т.пл.+32 °С, т.разл. 100 °С. Хорошо растворим в воде, образует NH2OH · H2O. Протолиз в водном р-ре: NH2OH + H2O NH3OH+ + OH pH > 7; Kо = 1,07 · 10–8 Катион гидроксиламиния NH3OH+ образует соли типа (NH3OH)Cl, (NH3OH)2SO4 … sp 3,sp 3 –гибридизация +

Окислительно-восстановительные свойства гидроксиламина Гидроксиламин как восстановитель рН 7: 2(NH2OH·H2O) + 2OH 2e = N2 + 6H2O; = –3,04 В рН 7: 2NH3OH+ 2e = N2 + 4H+ + 2H2O; = –1,87 В Гидроксиламин как окислитель рН 7: (NH2OH·H2O) + H2O +2e = NH3·H2O + 2OH; = +0,52 В рН 7: NH3OH+ + 2H+ + 2e = NH4+ + H2O; = +1,35 В Получение: пропускание смеси NO и H2 через суспензию катализатора (Pt) в разб. HCl

Азидоводород HN3 HN3 – бесцветная летучая жидкость, неограниченно растворимая в воде (при содержании в растворе свыше 3% масс. – взрывоопасен). Протолиз в водн. р-ре: HN3 + H2O N3 + H3O+ рН 7; KK = 1,90 · 10–5 Азид-анион N3 имеет линейную форму. Соли MN3 подвергаются гидролизу (рН 7). Соли MN3 (M = Ag, Cu…) взрывоопасны (разл. на металл и N2). N N N H N N N H тип гибридизации sp 2, sp , , ,, тип гибридизации sp, sp Таутомерия = 0,85 Д

Окислительно-восстановительные свойства Восстановительные свойства азидоводорода в растворе обусловлены легкостью превращения его в молекулярный азот: 2HN3 2e = 3N2 + 2H+; = –3,10 В Азидоводород – окислитель по отношению к веществам с сильными восстановительными свойствами: HN3 + 3HI = N2 + NH4I + I2


![Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3 Степени окисления: –III, 0, +III, +V ns 2 np 3 nd 0 Валентные возможности: N – 3, 4; P, As, Sb, Bi – 3 6 Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3 Степени окисления: –III, 0, +III, +V ns 2 np 3 nd 0 Валентные возможности: N – 3, 4; P, As, Sb, Bi – 3 6](https://fs1.ppt4web.ru/images/3018/54497/640/img2.jpg)
![Гидроксиды, кислоты Э+III Э+V N P As Sb Bi HNO2 HNO3 H2(PHO3) H3PO4, (HPO3)x H3AsO3 H3AsO4 Sb2O3 ·n H2O Sb(NO3)3 K[Sb(OH)4] Sb2O5 ·n H2O H[Sb(OH)6](р) Bi(OH)3, BiO(OH) Сильная кислота Слабые кислоты Слабые кислоты Сильная кислота Основный гидроксид … Гидроксиды, кислоты Э+III Э+V N P As Sb Bi HNO2 HNO3 H2(PHO3) H3PO4, (HPO3)x H3AsO3 H3AsO4 Sb2O3 ·n H2O Sb(NO3)3 K[Sb(OH)4] Sb2O5 ·n H2O H[Sb(OH)6](р) Bi(OH)3, BiO(OH) Сильная кислота Слабые кислоты Слабые кислоты Сильная кислота Основный гидроксид …](https://fs1.ppt4web.ru/images/3018/54497/640/img6.jpg)












![Протоноакцепторные свойства N2H4 – акцептор протонов (две неподеленные пары электронов): N2H4 + H3O+ = N2H5+ + H2O катион гидразиния(1+) N2H4 + 2H3O+ = N2H62+ + 2H2O катион гидразиния(2+) Соли: [N2H5]Cl, [N2H5]2SO4, [N2H6]SO4 (получ. в изб.к-ты) Протоноакцепторные свойства N2H4 – акцептор протонов (две неподеленные пары электронов): N2H4 + H3O+ = N2H5+ + H2O катион гидразиния(1+) N2H4 + 2H3O+ = N2H62+ + 2H2O катион гидразиния(2+) Соли: [N2H5]Cl, [N2H5]2SO4, [N2H6]SO4 (получ. в изб.к-ты)](https://fs1.ppt4web.ru/images/3018/54497/640/img24.jpg)