Презентация на тему: КИСЛОРОД и сера

КИСЛОРОД

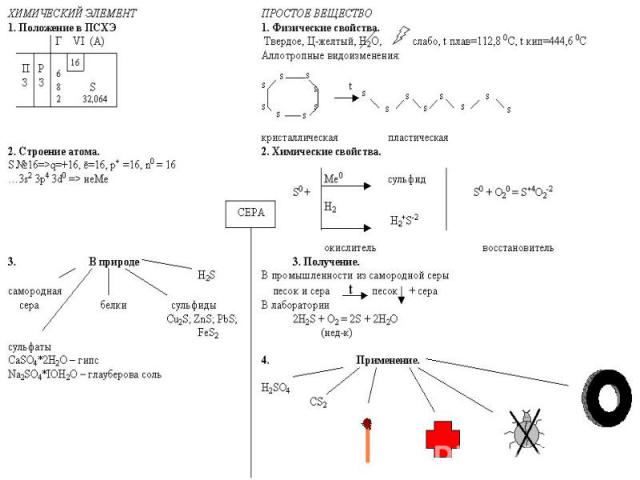
Положение в периодической системе КИСЛОРОД и СЕРА элементы VIA группы периодической системы Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ, что означает «рождающие руды»

Строение атома КИСЛОРОДА Электронные конфигурации атома:

Аллотропия КИСЛОРОДА Два аллотропных видоизменения химического элемента кислорода: кислород О2 озон О3

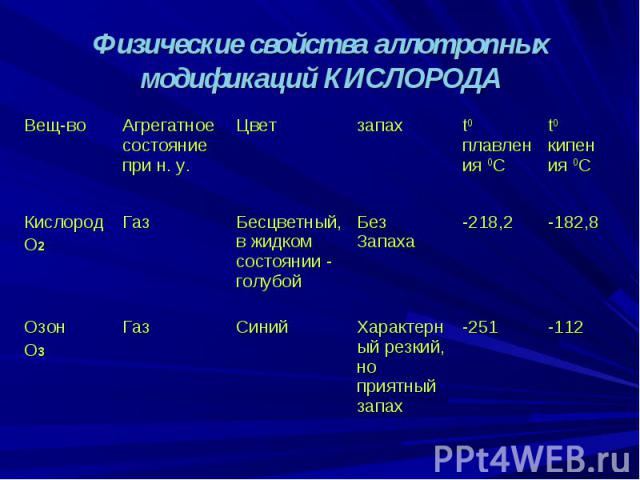
Физические свойства аллотропных модификаций КИСЛОРОДА

Озон химически активнее кислорода: Озон химически активнее кислорода: Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами. O3=>O2+O Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании: Но в то же время и озон и кислород реагируют с активными металлами.

Получение озона Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека. Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона. Получение озона Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека. Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.

Получение кислорода Кислород (O2) в лаборатории получают разложением перманганата калия KMnO4 (марганцовки). 2KMnO4 = K2MnO4 + MnO2 + O2 ↑

В лаборатории кислород можно так же получать разложением других солей при нагревании В лаборатории кислород можно так же получать разложением других солей при нагревании 2KNO3=>2KNO2+O2 2KClO3=>2KCl+3O2 В промышленности кислород получают из жидкого воздуха (при охлаждении до to -283Co) или в результате электролиза воды 2H2O= 2H2+O2 В природе кислород образуется в процессе фотосинтеза 6CO2+6H2O=> C6H12O6+6O2 ↑

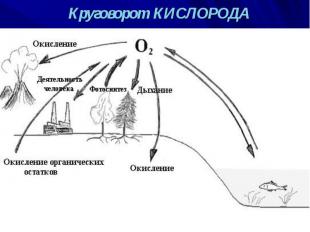
Химические свойства КИСЛОРОДА Кислород непосредственно реагирует со всеми простыми веществами, кроме золота, платины и галогенов.

Взаимодействие с активными металлами Горение магния 2Mg + O2= 2MgO

Взаимодействие с другими неметаллами Горение серы в кислороде S + O2= SO2

Горение углерода в кислороде Горение углерода в кислороде С+О2= СО2

Применение КИСЛОРОДА В химической промышленности В производстве взрывчатых смесей При сварке и резке металлов В космической технике (ракетное топливо) В металлургической промышленности В дыхательных смесях В медицине
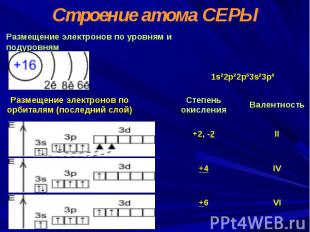
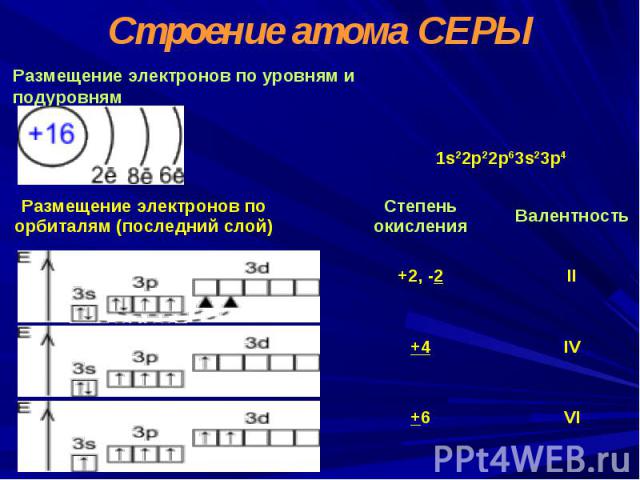
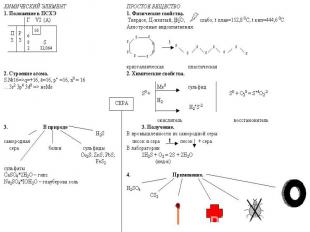
Строение атома СЕРЫ

Аллотропия СЕРЫ

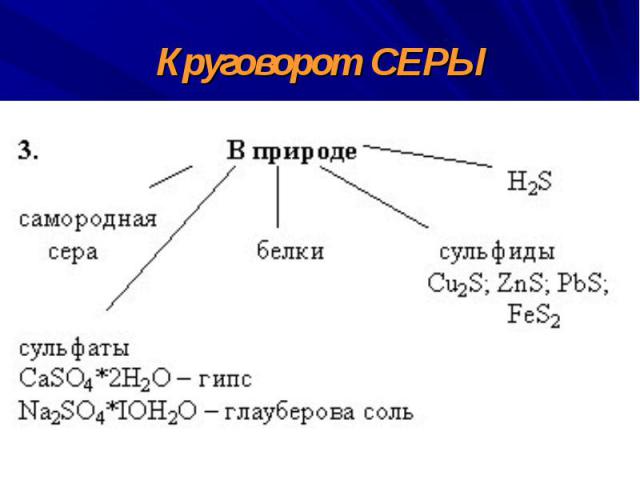
Получение СЕРЫ 1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Неполное окисление сероводорода (при недостатке кислорода). 2H2S + O2 => 2S + 2H2O 3. Реакция Вакенродера 2H2S + SO2 => 3S + 2H2O

Химические свойства СЕРЫ Окислительные свойства серы (S0 + 2ē => S-2) 1) Сера реагирует со щелочными металлами без нагревания: 2Na + S => Na2S c остальными металлами (кроме Au, Pt) - при повышенной t°: 2Al + 3S =t°=> Al2S3 Zn + S =t°=> ZnS 2) С некоторыми неметаллами сера образует бинарные соединения: H2 + S => H2S 2P + 3S => P2S3 C + 2S => CS2

Восстановительные свойства сера проявляет в реакциях с сильными окислителями: (S0 - 2ē => S+2; S0- 4ē => S+4; S0 - 6ē => S+6) Восстановительные свойства сера проявляет в реакциях с сильными окислителями: (S0 - 2ē => S+2; S0- 4ē => S+4; S0 - 6ē => S+6) 3) c кислородом: S + O2 =t°=> S+4O2 2S + 3O2 =t°pt=> 2S+6O3 4) c галогенами (кроме йода): S + Cl2 => S+2Cl2 5) c кислотами - окислителями: S + 2H2SO4(конц) => 3S+4O2 + 2H2O S + 6HNO3(конц) => H2S+6O4 + 6NO2 + 2H2O
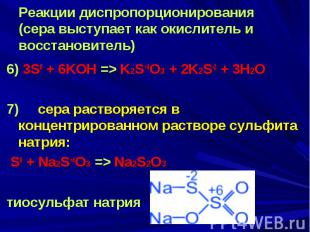
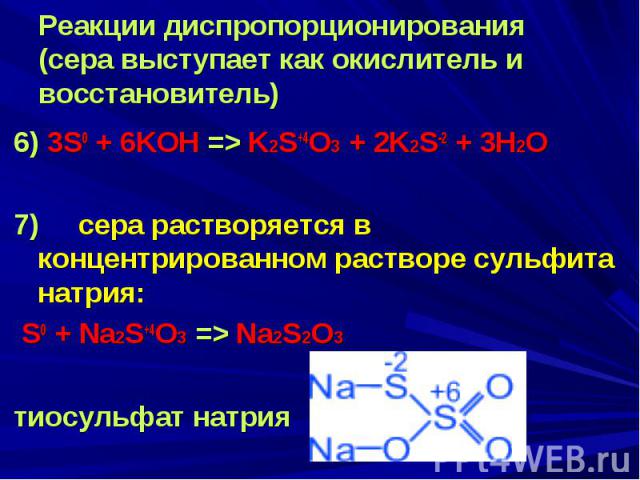
Реакции диспропорционирования (сера выступает как окислитель и восстановитель) 6) 3S0 + 6KOH => K2S+4O3 + 2K2S-2 + 3H2O 7) сера растворяется в концентрированном растворе сульфита натрия: S0 + Na2S+4O3 => Na2S2O3 тиосульфат натрия
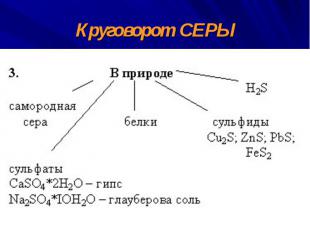
Круговорот СЕРЫ

Применение СЕРЫ Вулканизация каучука Получение эбонита Производство спичек, пороха В борьбе с вредителями сельского хозяйства Для медицинских целей (серные мази для лечения кожных заболеваний) Для получения серной кислоты

СПАСИБО ЗА ВНИМАНИЕ!!!