Презентация на тему: "Гидролиз органических и неорганических соединени"

Учитель химии Бимской СОШ Тоюшева Эльвера Петровна

Цель урока: повторить гидролиз солей, закрепить полученные знания, отработать навыки составления уравнений реакции гидролиза, предсказывать продукты гидролиза, условия смещения реакции гидролиза.

Оборудование и реактивы: соли, образованные разными по силе кислотами и основаниями –сульфаты, хлориды, нитраты, карбонаты, ацетаты, феноляты, алкоголяты, индикаторная бумага, вода, пробирки.

что же это за реакция – гидролиз? Гидролиз от греческого лизис – разложение, гидро-вода Гидролиз – это взаимодействие ионов соли с ионами водорода Н+ или гидроксид ионами ОН- молекул воды, в результате которого образуется слабый электролит.

отличие реакции гидролиза от реакции нейтрализации Гидролиз – это реакция, обратная реакции нейтрализации, в которой теплота поглощается и изменяется рН среды. Гидролизу подвергаются как неорганические соли так и органические.

Как долго протекает процесс гидролиза Процесс гидролиза протекает до тех пор, пока не установится равновесие между ионами соли, водой и продуктами гидролиза Не следует путать гидролиз с гидратацией, где ионы соли реагируют с молекулами воды.

Пример (Задание КИМа): К реакции гидролиза не относится: 1) СНзСООNа + H2 O 2) K2SiO3 + H2O 3) Na2O + H2O 4) AI4C3 + H2O

Чтобы точно определить продукты гидролиза, мы должны знать силу кислот и оснований Сильные - HNO3, H2SO4, H2SeO4 HCIO3, НСlO4, HBr,НI, HCl, HMnO4 , HIO3, HBrO3, NaOH, KOH, Ca(OH)2, Ba(OH)2, Слабые: H2CO3, H2SO3, HNO2, H3PO4, H3BO3, H2SiO3, HF, NH4OH, вода, HBrO, HCIO, HCN, H2S, HCIO2, Zn (OH)2, AI (OH)3, Fe(OH)3

Пример (Задание КИМа): данные органические вещества расположить в порядке усиления кислотных свойств: С2H5OH-этиловый спирт, C6Н5ОН-фенол, СН3СООН-уксусная кислота, СН3-СН2- СООН - пропионовая кислота, глицерин, этиленгликоль, CH2CI – COOH –хлоруксусная кислота, вода и сравнить с соляной кислотой НСl, объяснить причину усиления кислотных свойств. (Чем слабее кислота, тем сильнее гидролиз).

выделяют 4 типа солей в зависимости от силы кислоты и основания. соли, образованные: сильным основанием и слабой кислотой подвергаются частичному гидролизу слабым основанием и сильной кислотой подвергаются частичному гидролизу слабым основанием и слабой кислотой подвергаются полному необратимому гидролизу сильным основанием и сильной кислотой, гидролизу не подвергаются.

алгоритм составления уравнения реакции гидролиза 1)Анализ состава соли, с целью определения силы основания и силы кислоты. 2)С ионом слабого электролита написать уравнение взаимодействия с составными частями одной молекулы воды ( т.е. краткое ионно-молекулярное уравнение) 3)Написать полное ионно- молекулярное уравнение.

написать реакцию гидролиза, пользуясь алгоритмом определить, каким основанием и какой кислотой (по силе) образована соль, с ионом слабого электролита записать реакцию. 1)KNO3 2)Na2CO3 3)AICI3 4)ZnSO3

1) KNO3 + H2O K+ +NO3- + H+ +OH- 1) KNO3 + H2O K+ +NO3- + H+ +OH- гидролиза нет, оба электролита сильные. 2) Na2CO3 + H2O NaOH + Na2HCO3 - рН > 7 частичный гидролиз 3) AICI3 + H2O AIOHCI2 + HCI - рН < 7 частичный гидролиз 4) ZnSO3 + 2H2O Zn(OH)2 + H2O + SO2 Полный необратимый гидролиз


Выводы:

Изменение цвета различных индикаторов при действии растворов кислот и щелочей

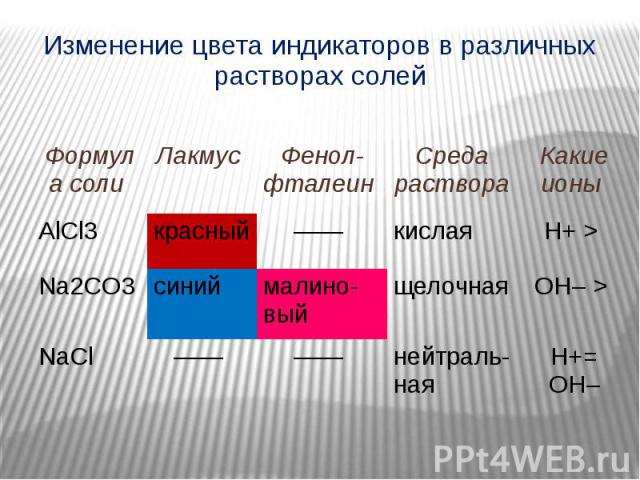
Изменение цвета индикаторов в различных растворах солей

Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+ Н2O ↔ Н+ + ОН– Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+ Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.

Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– СO32– + Н2O ↔ НСO3– + ОН– Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.

Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ + Сl– + Н2O ↔ Na+ + Cl– + H2O Одинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).


Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария Составьте ионное уравнение гидролиза этих солей.

Пример с органическими соединениями Способность солей подвергаться гидролизу увеличивается в ряду a) C2H5ONa, CH3COONa, C6H5ONa б) CH3 COONa, C2H5ONa, C6H5ONa в) C6H5ONa , C2H5ONa, CH3COONa г) CH3COO-Na, C6H5O-Na , C2H5O-Na - слабая кислота слабее еще слабее уксусная фенол этанол

Домашнее задание: 1.Творческое задание: составить задания части А и части В по теме «Гидролиз» 2.Повторить: гидролиз белков, нуклеиновых кислот, углеводов, жиров(щелочной, водный, кислотный, ферментативный), эфиров(в кислой среде,щелочной).