Презентация на тему: "Галогены"


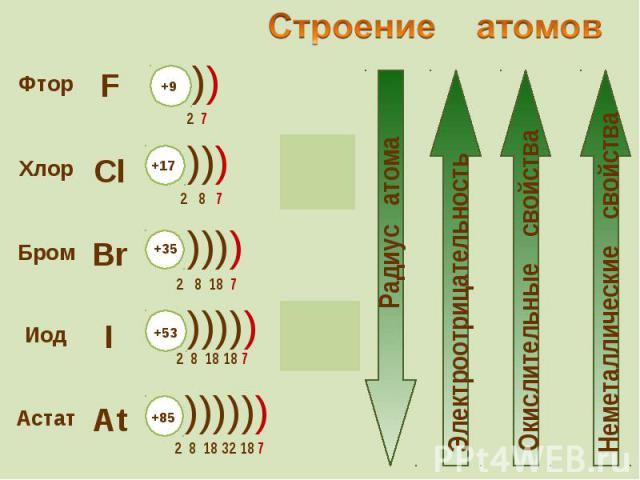
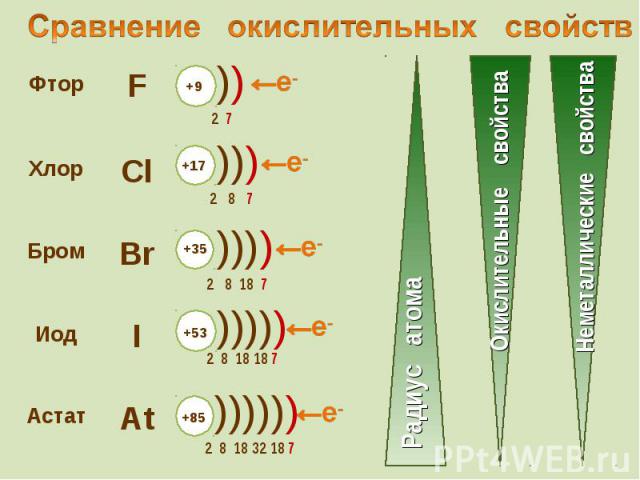
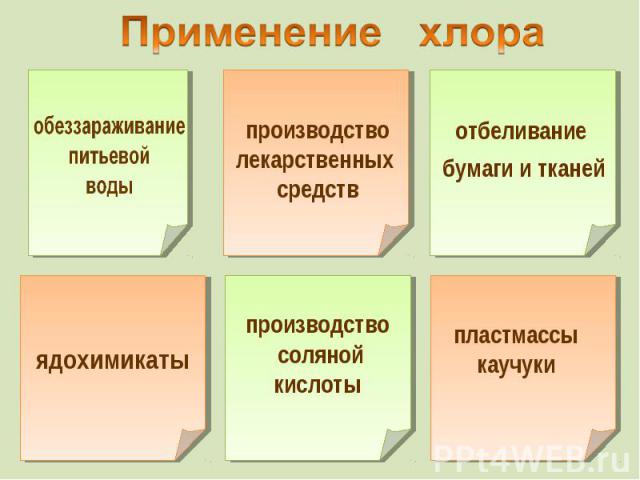
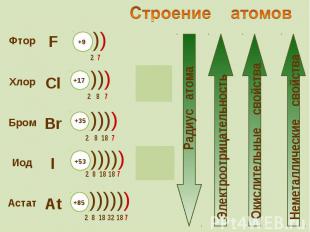
К элементам VII группы, главной подгруппы относятся К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат At

В свободном виде не встречаются В свободном виде не встречаются



Иод — элемент редкий Иод — элемент редкий

Название "фтор" (от греческого phthoros - разрушение, гибель) Название "фтор" (от греческого phthoros - разрушение, гибель)

Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Хлор был открыт шведским химиком Карлом Шееле в 1774 г.

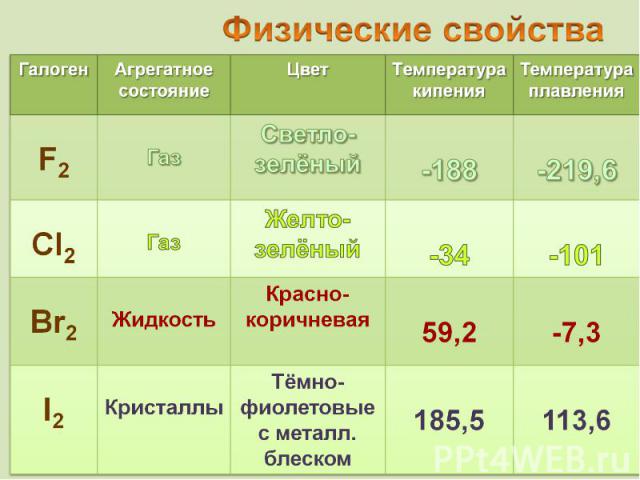
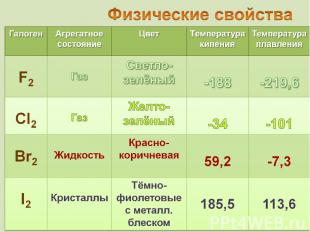
от греч. bromos – зловоние от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре

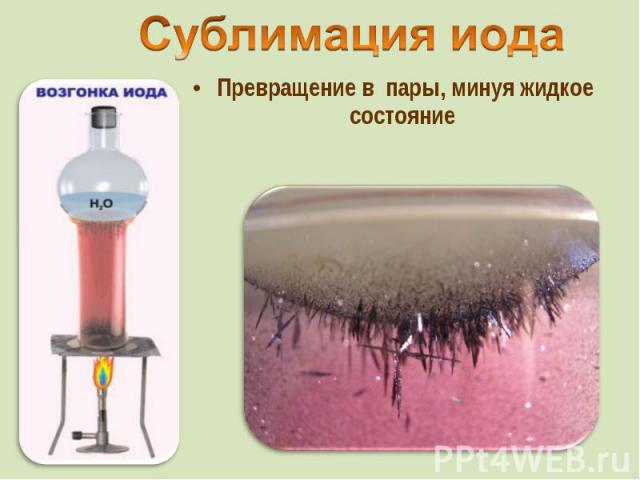
от греч. iodes—имеющий фиалковый цвет от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары -фиолетового цвета

Превращение в пары, минуя жидкое состояние Превращение в пары, минуя жидкое состояние

Молекулы галогенов состоят из двух атомов. Молекулы галогенов состоят из двух атомов.
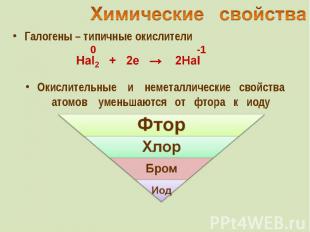
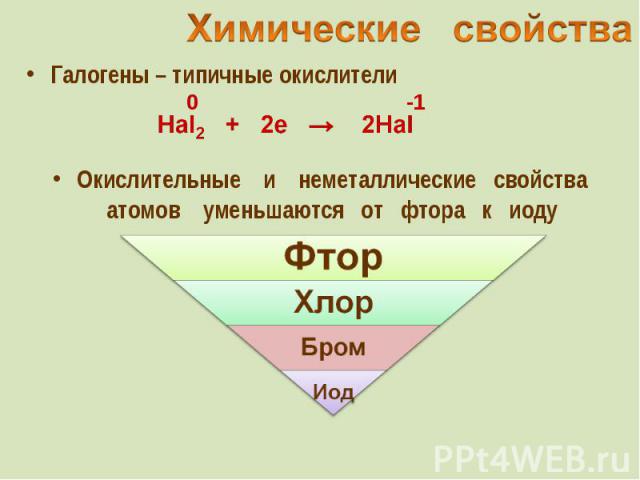
Галогены – типичные окислители Галогены – типичные окислители
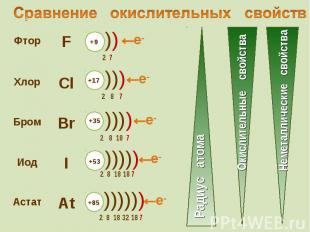

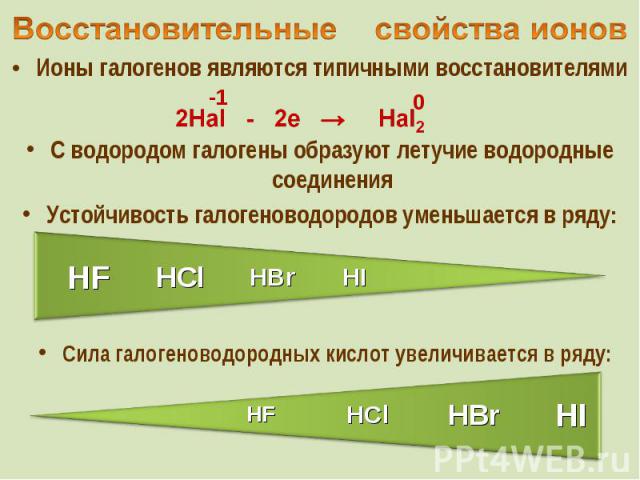
Ионы галогенов являются типичными восстановителями Ионы галогенов являются типичными восстановителями
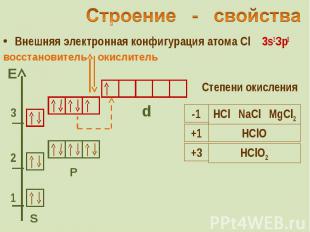
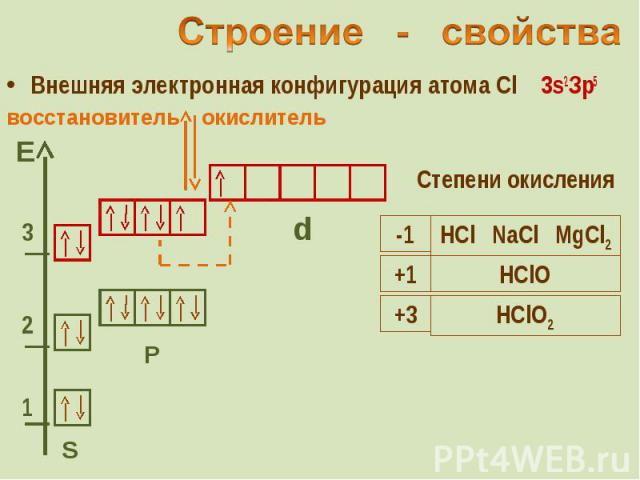
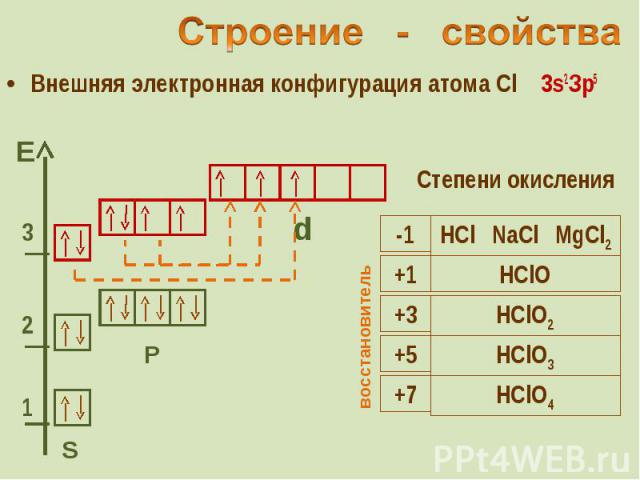
Внешняя электронная конфигурация атома Cl 3s2Зр5 Внешняя электронная конфигурация атома Cl 3s2Зр5
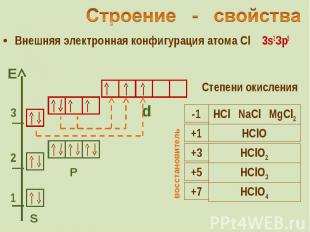
Внешняя электронная конфигурация атома Cl 3s2Зр5 Внешняя электронная конфигурация атома Cl 3s2Зр5

1. Взаимодействие с металлами 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):

3. Взаимодействие с водой 3. Взаимодействие с водой с образованием смеси кислот

В промышленности: электролиз расплава или раствора хлорида натрия В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории:
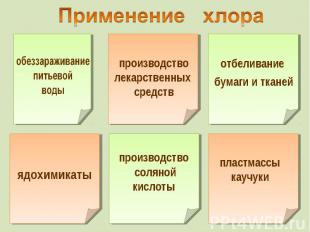


Что значит название «Галогены»? Что значит название «Галогены»? В чём сходство электронного строения этих элементов? Какие свойства в окислительно-восстановительном плане проявляют галогены? Какой галоген наиболее химически активен? Как изменяется активность галогенов вниз по группе?

Учебник «Химия-9» Учебник «Химия-9» § 13, 14 стр. 71 № 1 – 4