Презентация на тему: Галогены 8 класс

Галогены Что это такое ?

Цель урока: Рассмотреть строение атомов галогенов их физические свойства. Изучить химические свойства галогенов.

Задачи: Образовательная: рассмотреть строение атомов галогенов. Физические свойства простых веществ. Изучить химические свойства галогенов. Развивающая: продолжить формирование умений учащихся сравнивать, обобщать и объяснять свойства, устанавливать причинно-следственные связи. Воспитательная: воспитывать у учащихся такие личностные качества, как сосредоточенность, умение работать в группе.

Аннотация Из 109 химических элементов 22 являются неметаллами. Неметаллы – простые вещества при обычных условиях могут быть газами, жидкостями и твердыми веществами. Среди них наиболее значительными являются элементы, входящие в главную подгруппу V11 группы: фтор, хлор, бром, йод и астат. Сегодня вы проведете независимое расследование этих неметаллов (класс делится на 5 групп) по следующим блокам: «Химия», «История», «Геология», «Биология», «Физика».

Проблема: Блок «История» Знак химического элемента Этимология названия Год открытия, автор Блок «Физика»

Блок «Биология»

Этапы и сроки выполнения проекта «Мозговой штурм» (формулирование тем исследований учеников) – 1 урок, 10 минут. Формирование групп для проведения исследований, выдвижение гипотез решения проблем – 1 урок, 5минут. Выбор творческого названия проекта (совместно с учащимися) – 1 урок, 5 минут. Обсуждение плана работы учащихся индивидуально или в группе – 1 урок, 10 минут. Обсуждение со школьниками возможных источников информации, вопросов защиты авторских прав – 1 урок, 10 минут. Самостоятельная работа учащихся по обсуждению задания каждого в группе – 1 урок, 5 минут. Самостоятельная работа групп по выполнению заданий, подготовка школьниками презентации по отчету о проделанной работе – домашнее задание. Защита полученных результатов и выводов – 2 урок.

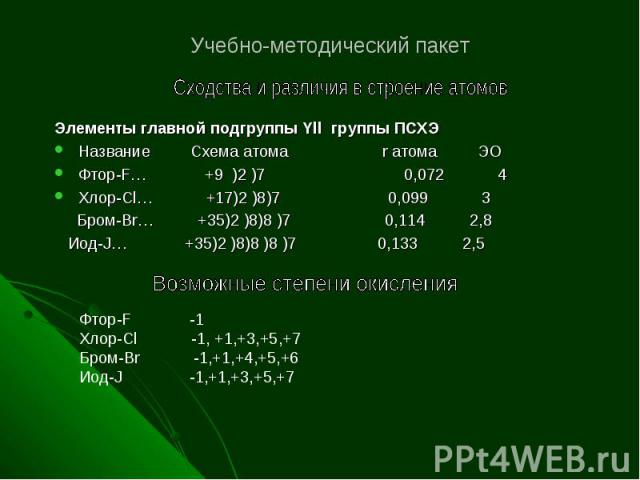
Учебно-методический пакет Элементы главной подгруппы Yll группы ПСХЭ Название Схема атома r атома ЭО Фтор-F… +9 )2 )7 0,072 4 Хлор-Cl… +17)2 )8)7 0,099 3 Бром-Br… +35)2 )8)8 )7 0,114 2,8 Иод-J… +35)2 )8)8 )8 )7 0,133 2,5 Фтор-F -1 Хлор-Cl -1, +1,+3,+5,+7 Бром-Br -1,+1,+4,+5,+6 Иод-J -1,+1,+3,+5,+7

F Cl F Cl Br I

Строение простого вещества Молекулы всех галогенов состоят из двух атомов F2 Cl2 Br2 J2. Связь в молекулах ковалентная неполярная F-F Cl-Cl Br-Br J-J, молекулы неполярные и образуют молекулярные неполярные кристаллические решетки. а) C увеличением атомной массы уменьшается неметаллический характер элементов. б) С увеличением атомной массы окраска становится более темной. в) С увеличением атомной массы возрастает температура плавления и кипения

Химические свойства галогенов Галогены сильнейшие окислители!!! Окислительные способности усиливаются в ряду: J Br CI F Фтор самый сильный окислитель в ПСХЭ! Его Э.О = 4 Он никогда не отдаёт свои электроны!

Нахождение в природе: Фтор-F2 Флюорит -CaF2 Бром-Br2 в аналогичных соединениях, вместе с хлором

Применение галогенов Фтор-F2 1.Для получения HF 2 Для получения фреона 3 Для получения веществ, иcполь. в борьбе с вредителями с/х 4. Для получения тефлона Хлор-Cl2 1 Для получения медикаментов, пластмасс, красителей. 2.Для отбеливания тканей и бумаги 3. Для обеззараживания питьевой воды. Бром-Br2 1.Для получения различных лекарств, исполь. при лечении нервных заболеваний 2.Для изготовления фотобумаги. Иод-J2 Используют в медицине для борьбы с заболеваниями щитовидной железы и получения иодной настойки (5-10% р-ра иода в спирте)