Презентация на тему: ГАЛОГЕНЫ

Выполнил: Выполнил: учитель химии первой квалификационной категории Сафиканов Ахат Файзрахманович



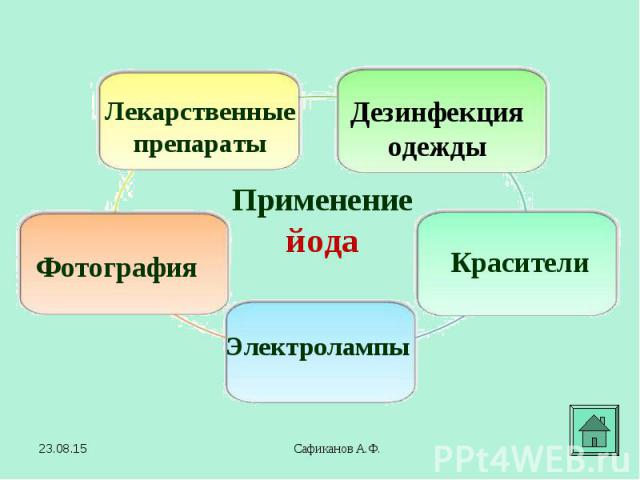
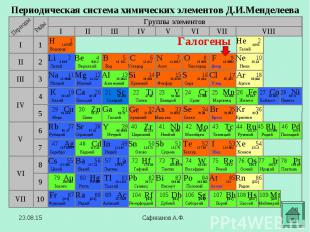
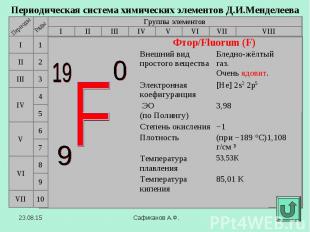
В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины.

В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал "дефлогистированной соляной кислотой". В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал "дефлогистированной соляной кислотой". В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый). В 1812 году Гей-Люсеок дал газу название хлор.

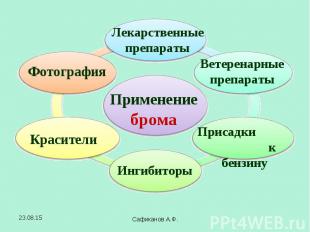
В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный"). В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный").

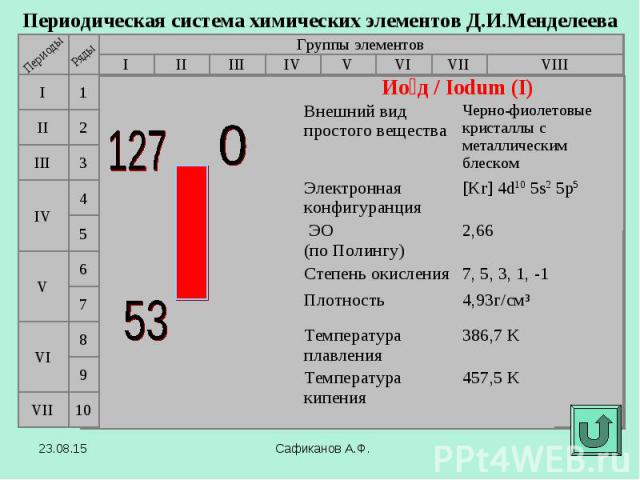
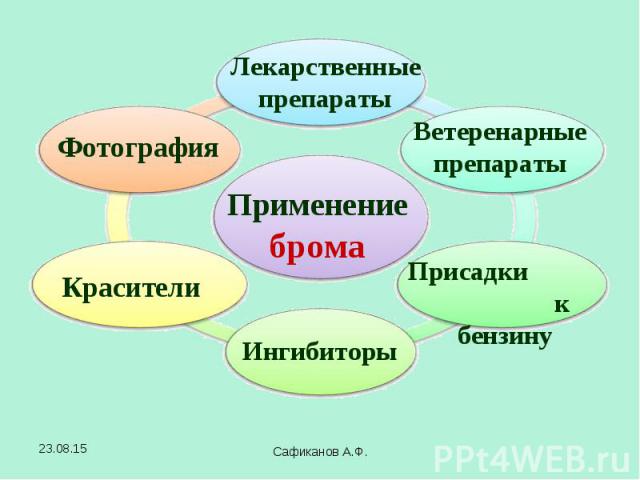
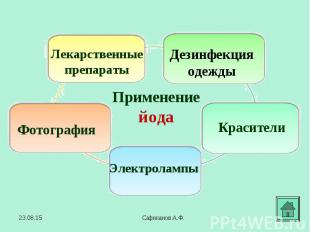
В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне. В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров).

В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат был получен искусственно в 1940 г открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли) . Для синтеза изотопа 211At они облучали висмут альфа-частицами. В 1943-1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.





С простыми веществами: С металлами С неметаллами Na + F2 → H2 + F2 → Mo + F2 → Xe + F2 → Со сложными веществами: H2O + F2 → KCl + F2 → KBr + F2 → KI + F2 →

С простыми веществами: С металлами С неметаллами 2Na + F2 → 2NaF H2 + F2 → 2HF Mo + 3F2 → MoF6 Xe + 2F2 → XeF4 Со сложными веществами: 2H2O + F2 → 4HF + O2 2KCl + F2 → Cl2 + 2NaF 2KBr + F2 → Br2 + 2КF 2KI + F2 → I2 + 2КF

С простыми веществами: С металлами С неметаллами Fe + Cl2 → H2 + Cl2 → Cu + Cl2 → P + Cl2 → Со сложными веществами: H2O + Cl2 → NaOH + Cl2 → KBr + Cl2 → KI + Cl2 →

С простыми веществами: С металлами С неметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 → 2HCl (tº, hυ) Cu + Cl2 → Cu Cl2 2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2) Со сложными веществами: H2O + Cl2 → HCl+HClO хлорная вода 2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода 2KBr + Cl2 → Br2 + 2КCl 2KI + Cl2 → I2 + 2КCl

С простыми веществами: С металлами С неметаллами Al + Br2 → H2 + Br2 → Cu + Br2 → P + Br2 → Со сложными веществами: Br2 + H2O → KI + Br2 →

С простыми веществами: С металлами С неметаллами 2Al + 3Br2 → 2AlBr3 H2 + Br2 → 2HCl Cu + Br2 → Cu Br2 2P + 5Br2 → 2PBr5 Со сложными веществами: Br2 + H2O → HBr + HBrO бромная вода 2KI + Br2 → I2 + 2КCl

С простыми веществами: С металлами С неметаллами Hg + I2 → H2 + I2 → Al + I2 → P + Br2 → Со сложными веществами: I2 + H2O → I2 + р-р крахмала →

С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 → 2HCl (tº) 2Al + 3I2 → 2AlI3 2P + 3Br2 → 2PI3 Со сложными веществами: I2 + H2O → HI + HIO I2 + р-р крахмала → темно-синее окрашивание





Спасибо за урок! Спасибо за урок! Благодарю за сотрудничество.