Презентация на тему: Галогены 9 класс

Галогены Дегтярева М.О.Московская область г. Королёв АОУ ЛНИП242-645-771

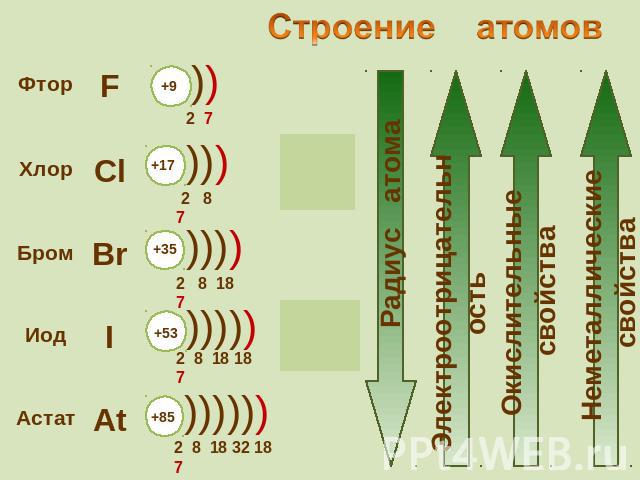
К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат At Общее название - галогены (греч. «солеобразующие») - большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).

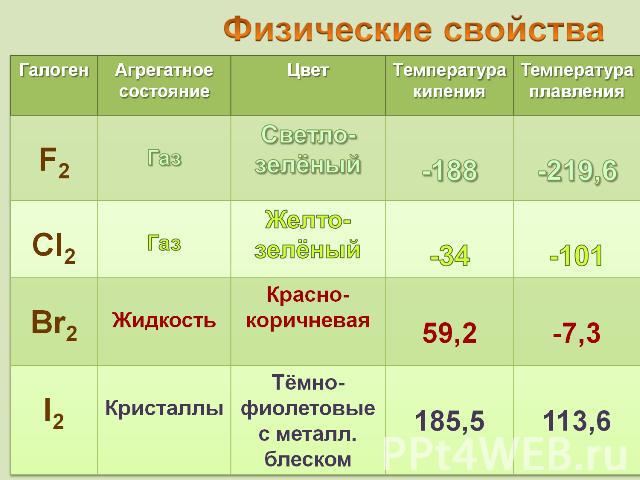
В свободном виде не встречаются Флюорит CaF2

Галит NaCl

Cильвинит KCl NaCl

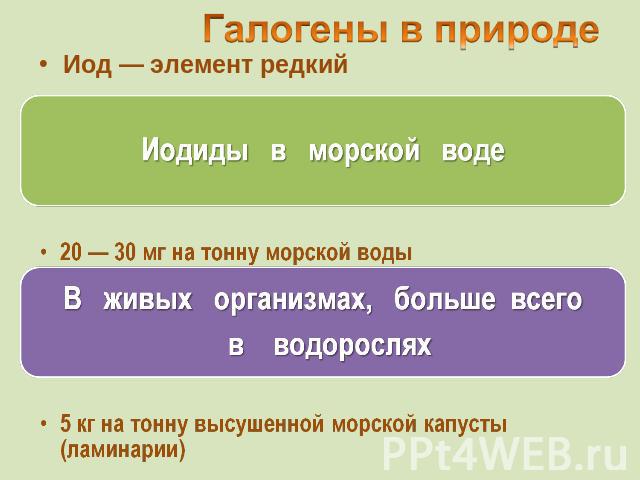
Иод — элемент редкий Иодиды в морской воде 20 — 30 мг на тонну морской водыВ живых организмах, больше всего в водорослях5 кг на тонну высушенной морской капусты (ламинарии)
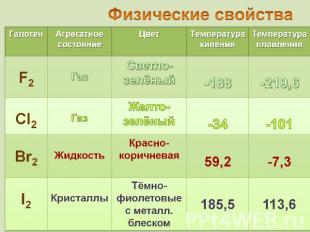

Название "фтор" (от греческого phthoros - разрушение, гибель) В свободном состоянии фтор был получен 26 июня 1886 г. французским химиком Муассаном. Это зеленовато-желтый газ, немного тяжелее воздуха, с характерным запахом и необыкновенной химической активностью. Ни один из химических элементов не принес химикам столько трагических событий, как фтор.

Хлор был открыт шведским химиком Карлом Шееле в 1774 г. в 1810 году сэр Гемфри Дэви назвал газ "хлорином"(Chlorine), от греческого "зелёный". Этот термин используется в английском языке, а в других языках закрепилось название "хлор". Газ желто-зеленого цвета с резким запахом, ядовит в 2,5 раза тяжелее воздуха в 1 объеме воды при 20 °С растворяется около 2 объемов хлора

79Вr (50,56%) 81Вr (49,44%) от греч. bromos – зловониеединственный неметалл, жидкий при комнатной температуре пары брома имеют желто-бурый цвет при температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском

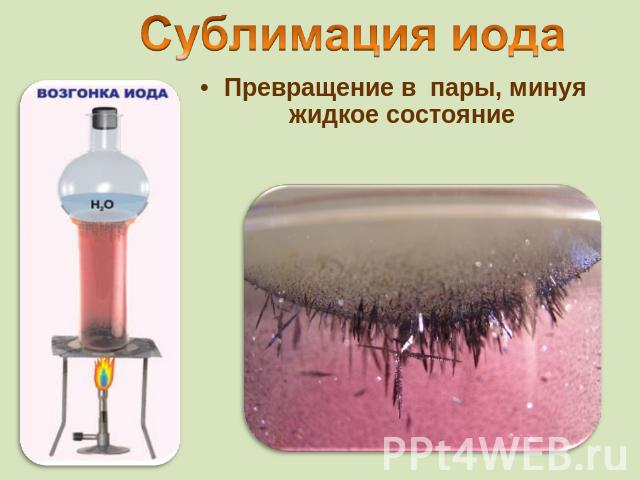
от греч. iodes—имеющий фиалковый цветв парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары -фиолетового цвета Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент Известны 37 изотопов иода с массовыми числами от 108 до 144.
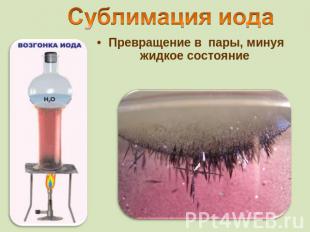
Превращение в пары, минуя жидкое состояние

Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная Cl + Cl → Cl Cl

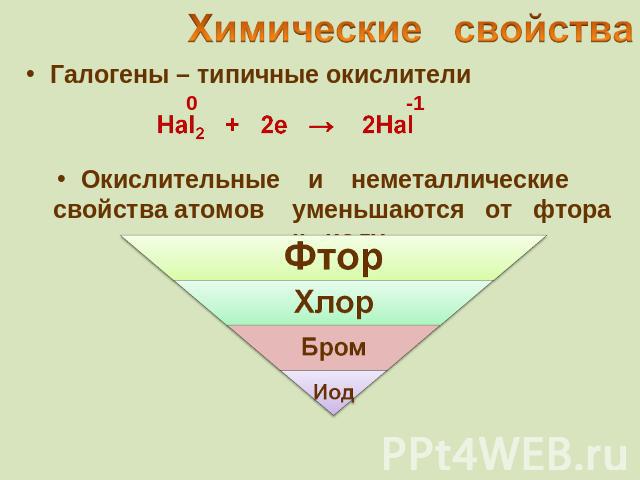
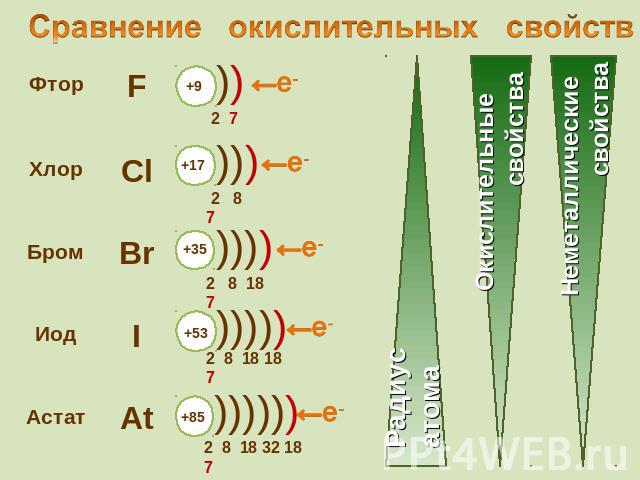
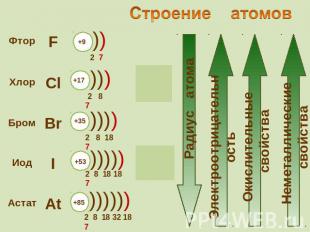
Галогены – типичные окислители Hal2 + 2e → 2Hal Окислительные и неметаллические свойства атомов уменьшаются от фтора к иоду
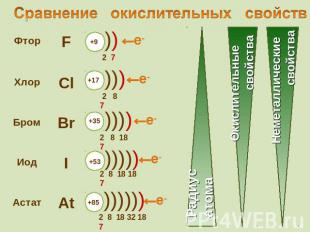
Сравнение окислительных свойств

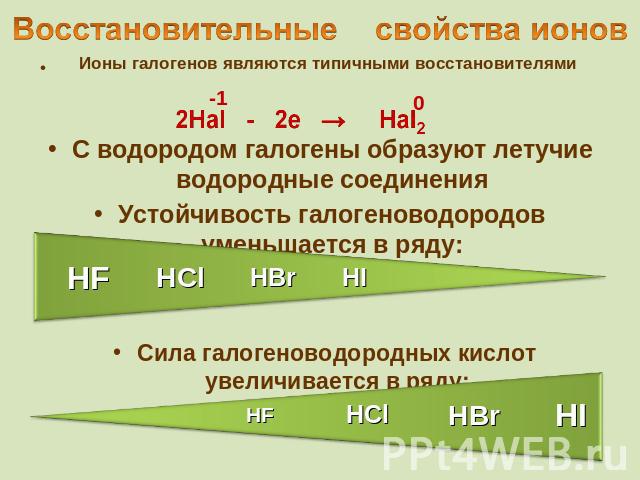
Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями 2Hal - 2e → Hal2 С водородом галогены образуют летучие водородные соединения Устойчивость галогеноводородов уменьшается в ряду: Cила галогеноводородных кислот увеличивается в ряду:
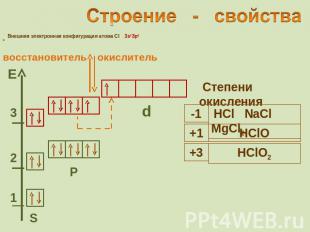
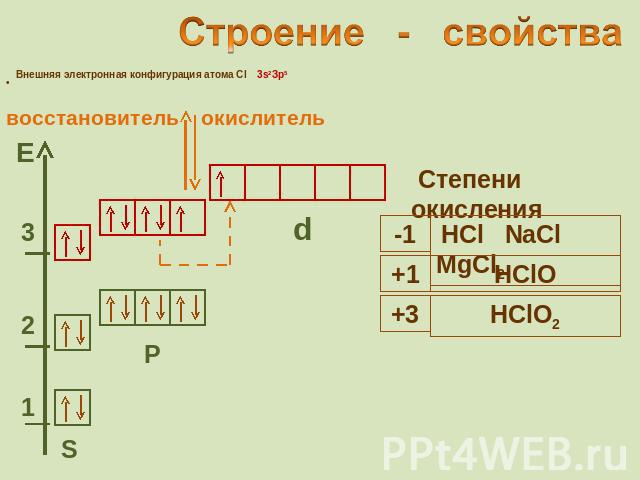
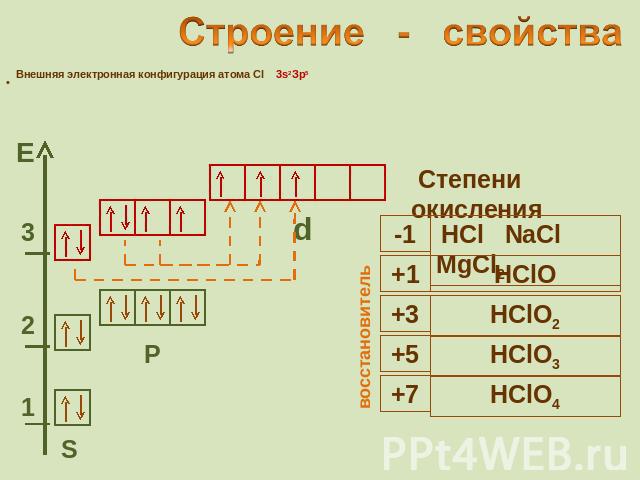
Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 восстановитель окислитель Степени окисления
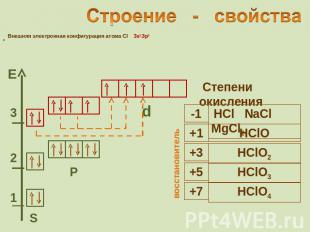
Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 Степени окисления

1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): 2Na + Cl2 → 2NaCl 2Fe + 3Cl2 → 2FeCl3 2. Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. Cl2 + H2 → 2HCl 5Cl2 + 2P → 2PCl5

3. Взаимодействие с водой с образованием смеси кислот Cl2 + H2О → HCl + HClO 4. Взаимодействие с солями других галогенов более активные галогены вытесняют менее активные из растворов их солей Cl2 + 2NaBr → 2NaCl + Br25. Взаимодействие с растворами щелочей с образованием солей 2NaOH + Cl2 → NaCl + NaClO + H2O 6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O

В промышленности: электролиз расплава или раствора хлорида натрияВ лаборатории:
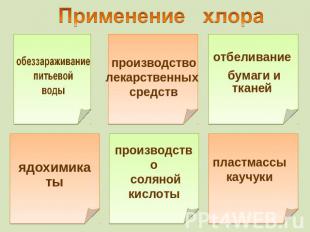
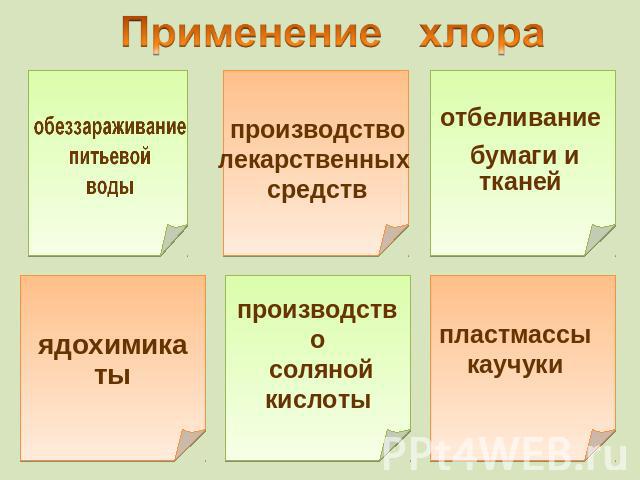
обеззараживание питьевой воды производстволекарственных средств отбеливание бумаги и тканей ядохимикаты производство соляной кислоты пластмассы каучуки

В медицине - 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения- В рентгенологических и томографических исследованиях применяются йодсодержащие контрастные препараты В технике - Галогенная лампа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода)- Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах

Что значит название «Галогены»?В чём сходство электронного строения этих элементов?Какие свойства в окислительно-восстановительном плане проявляют галогены?Какой галоген наиболее химически активен?Как изменяется активность галогенов вниз по группе?

Учебник «Химия-9»§ 13, 14 стр. 71 № 1 – 4