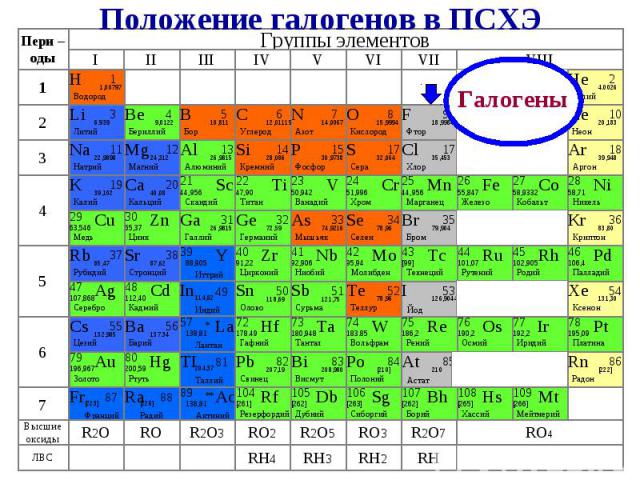
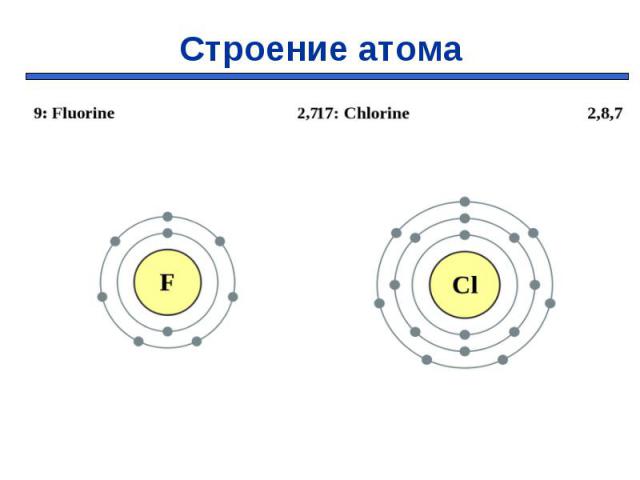
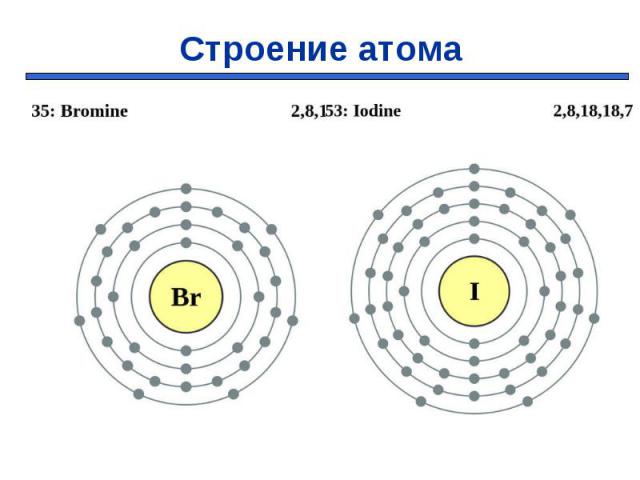
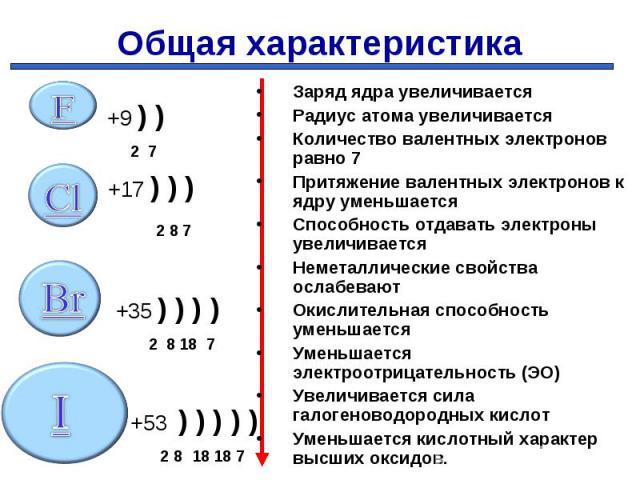
Презентация на тему: Галогены




В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора А. Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора А. Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины.

В 1774 году шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах». В 1774 году шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах». В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый). В 1812 году Гей-Люсеок дал газу название хлор.

В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный"). Балар писал: «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл» . В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный"). Балар писал: «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл» .

В 1811 году французский химик Бернар Куртуа открыл йод путём перегонки маточных растворов от азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (фармацевтической фирме в Дижоне. В 1811 году французский химик Бернар Куртуа открыл йод путём перегонки маточных растворов от азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (фармацевтической фирме в Дижоне. В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров).

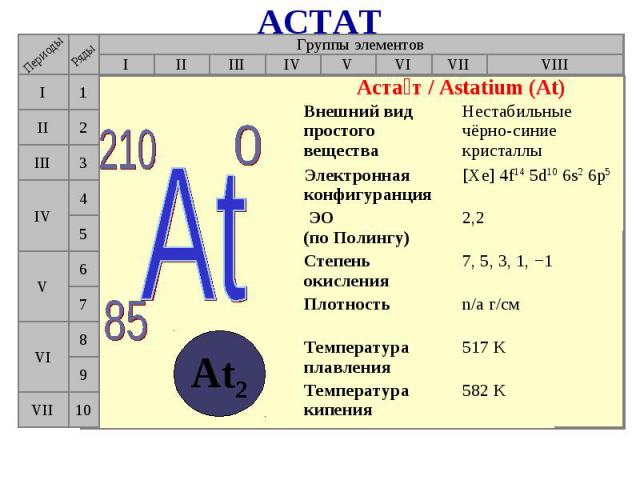
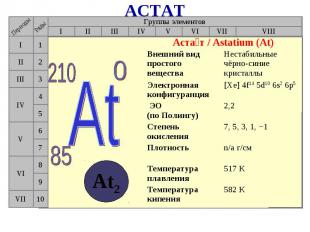
В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат был получен искусственно в 1940 г. открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211At они облучали висмут альфа-частицами. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.











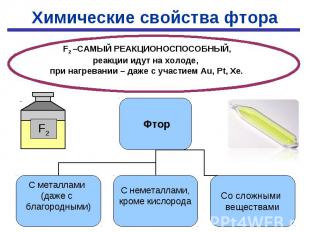

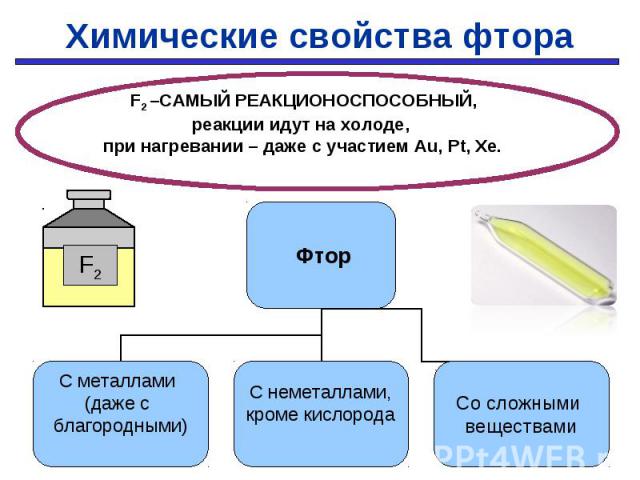
С простыми веществами: С простыми веществами: С МЕталлами С Неметаллами 2Na + F2 → 2NaF H2 + F2 → 2HF Mo + 3F2 → MoF6 Xe + 2F2 → XeF4 Со сложными веществами: 2H2O + F2 → 4HF + O2 2KCl + F2 → Cl2 + 2NaF 2KBr + F2 → Br2 + 2КF 2KI + F2 → I2 + 2КF
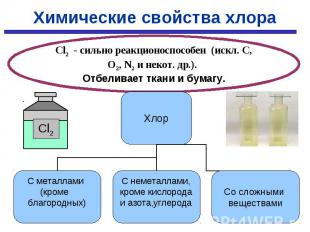

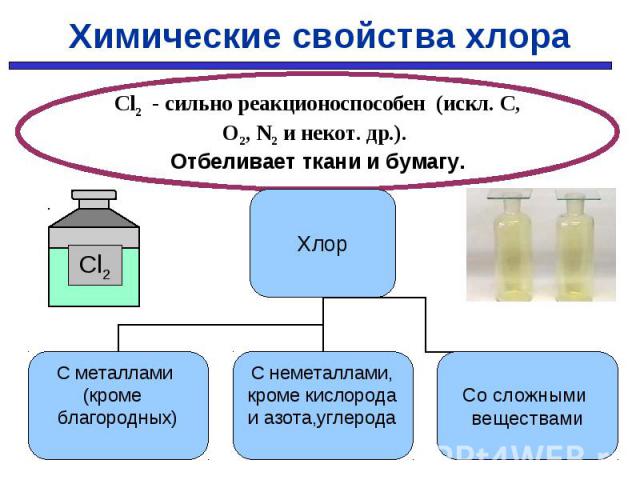
С простыми веществами: С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 → 2HCl (tº, hυ) Cu + Cl2 → Cu Cl2 2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2) Со сложными веществами: H2O + Cl2 → HCl+HClO 2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода 2KBr + Cl2 → Br2 + 2КCl 2KI + Cl2 → I2 + 2КCl
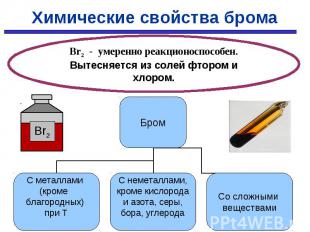
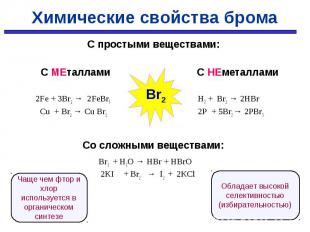
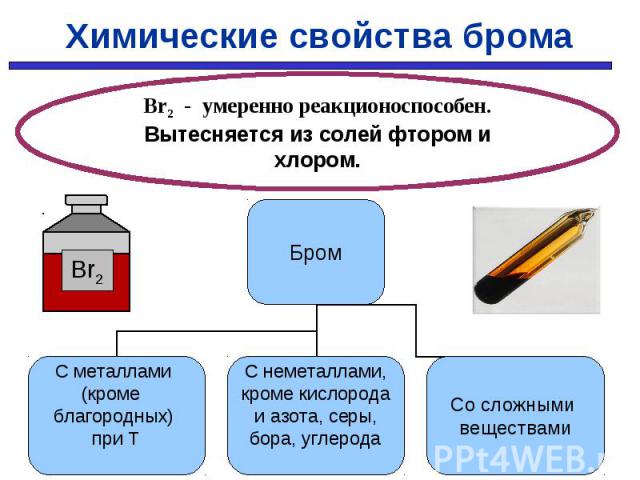
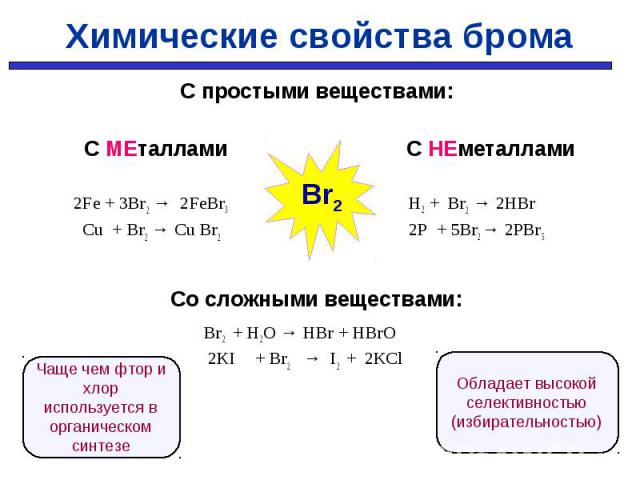
С простыми веществами: С простыми веществами: С МЕталлами С НЕметаллами 2Fe + 3Br2 → 2FeBr3 H2 + Br2 → 2HBr Cu + Br2 → Cu Br2 2P + 5Br2 → 2PBr5 Со сложными веществами: Br2 + H2O → HBr + HBrO 2KI + Br2 → I2 + 2КCl
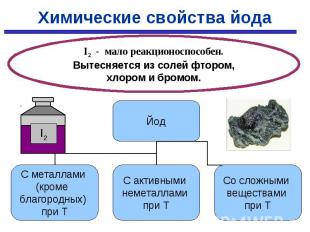

С простыми веществами: С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 → 2HI (tº) 2Al + 3I2 → 2AlI3 2P + 3Br2 → 2PI3 Со сложными веществами: I2 + H2O → HI + HIO (практически не идет) I2 + р-р крахмала → темно-синее окрашивание

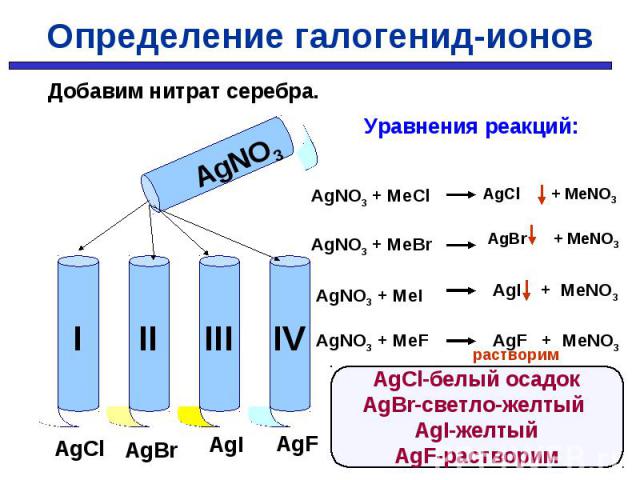
Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида
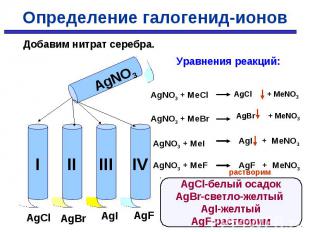
Добавим нитрат серебра. Добавим нитрат серебра.
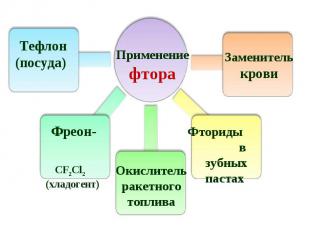
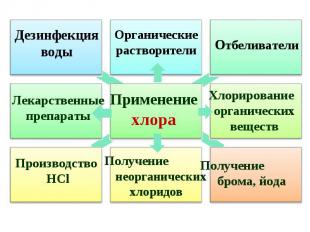
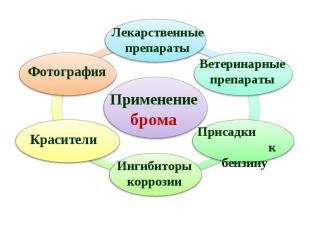
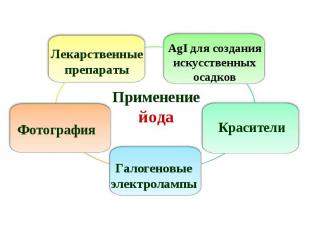


Составьте кроссворд по теме «Галогены» Ключевым словом является слово «АСТАТ». Составьте кроссворд по теме «Галогены» Ключевым словом является слово «АСТАТ». Решите задачу: Определите объем хлора (н.у), который образуется при действии на 5,8 г перманганата калия раствора соляной кислоты массой 100 г, с массовой долей кислоты 36%.


«Химия в действии», М. Фримантл, М, «Мир»,1991г, стр. 269-286. «Химия в действии», М. Фримантл, М, «Мир»,1991г, стр. 269-286. «Неорганическая химия в таблицах», Н.В.Манцевич, Минск, Современная школа, 2008г, стр 275-280. http://int-46.ucoz.ru/load/13-1-0-155